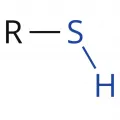
Тиолы
Тио́лы (тиоспирты, устаревшее – меркаптаны), сераорганические соединения общей формулы R─SH, где R – алкил (алкантиолы) или арил (арентиолы, тиофенолы). Водородные связи между молекулами тиолов слабее, чем у спиртов, и температура кипения тиолов ниже, чем у кислородных аналогов.
Физико-химические свойства
Тиолы малорастворимы в воде, растворимы в органических растворителях (этиловый спирт,
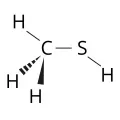 Структурная формула метантиола.диэтиловый эфир и др.). Низшие алифатические тиолы, за исключением газообразного метантиола CH3SH, – жидкости, имеют очень сильный неприятный запах, который обнаруживается при концентрациях до 2·10–9 мг/дм3 (т. н. короли зловония); смесь тиолов содержится в выделениях скунсов, в продуктах гниения белков. Тиолы – слабые кислоты (образуют соли – тиолаты), вступают в реакции присоединения по кратным связям, легко окисляются с образованием дисульфидов, в жёстких условиях – до сульфокислот.
Структурная формула метантиола.диэтиловый эфир и др.). Низшие алифатические тиолы, за исключением газообразного метантиола CH3SH, – жидкости, имеют очень сильный неприятный запах, который обнаруживается при концентрациях до 2·10–9 мг/дм3 (т. н. короли зловония); смесь тиолов содержится в выделениях скунсов, в продуктах гниения белков. Тиолы – слабые кислоты (образуют соли – тиолаты), вступают в реакции присоединения по кратным связям, легко окисляются с образованием дисульфидов, в жёстких условиях – до сульфокислот.
Способы получения
Алифатические тиолы получают взаимодействием H2S c алкенами или спиртами, алкилированием тиосульфата или тиомочевины алкилгалогенидами с последующим омылением полупродуктов щёлочью. Общим методом синтеза алифатических и ароматических тиолов является взаимодействие реактивов Гриньяра с серой.
Применение
Тиолы применяются в качестве одорантов бытового газа (этантиол) для определения утечки газа по запаху. Используют в качестве сырья для синтеза пестицидов, лекарственных препаратов, стабилизаторов полимеризации и др. Токсичны.