Fluorid antimoničný
Vzhled
| Fluorid antimoničný | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Fluorid antimoničný |
| Anglický název | Antimony pentafluoride |
| Německý název | Antimon(V)-fluorid |
| Sumární vzorec | SbF5 |
| Vzhled | Bezbarvá viskózní kapalina |
| Identifikace | |
| Registrační číslo CAS | 7783-70-2 |
| Vlastnosti | |
| Molární hmotnost | 216,74 g/mol |
| Teplota tání | 8,3 °C |
| Teplota varu | 149,5 °C |
| Hustota | 2,997 g/m3 (23 °C) |
| Rozpustnost ve vodě | reaguje |
| Rozpustnost v polárních rozpouštědlech | rozpouští se v kapalném SO2 a SO2FCl |
| Tlak páry | 13 hPa (25 °C) |
| Termodynamické vlastnosti | |
| Entalpie varu | 200,2 J/g |
| Měrné teplo | 0,496 J.kg−1.K−1 (konst. tlak, 25 °C, plyn) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R20/22, R51/53 |
| S-věty | S2, S61 |
| NFPA 704 |  0
4
1
|
Některá data mohou pocházet z datové položky. | |
Fluorid antimoničný je sloučeninou antimonu a fluoru, jeho chemický vzorec je SbF5. Za normálních podmínek to je bezbarvá kapalina. Má velmi silné korozivní účinky a je toxický. S vodou reaguje za vzniku plynného fluorovodíku.
Fluorid antimoničný je součástí kyseliny fluoroantimoničné, která je nejsilnější známou kyselinou o 100% koncentraci.[2]
Příprava
[editovat | editovat zdroj]Fluorid antimoničný lze připravit reakcí chloridu antimoničného s bezvodým fluorovodíkem:[3][4]
- SbCl5 + 5 HF → SbF5 + 5 HCl
Další možnou přípravou je reakce fluoridu antimonitého s fluorem.[4][5]
- SbF3 + F2 → SbF5
Struktura
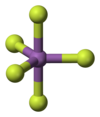
[editovat | editovat zdroj]V plynném stavu je fluorid antimoničný monomerní, molekula má tvar trigonální bipyramidy, grupa symetrie D3h. V pevném stavu vytváří cyklické tetramerní molekuly {SbF5}4, tvořené oktaedry SbF6 propojenými vrcholy.[4][6]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]- ↑ a b Antimony pentafluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Olah, G. A. A Life of Magic Chemistry: Autobiographical Reflections of a Nobel Prize Winner. [s.l.]: John Wiley and Sons, 2001. ISBN 0-471-15743-0. S. 100–101.
- ↑ GRUND, Sabina C.; HANUSCH, Kunibert; BREUNIG, Hans J. Antimony and Antimony Compounds. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 9783527306732. DOI 10.1002/14356007.a03_055.pub2. (anglicky) DOI: 10.1002/14356007.a03_055.pub2.
- ↑ a b c HOUSECROFT, Catherine; SHARPE, Alan. Anorganická chemie. 1. vyd. Praha: VŠCHT, 2014. 1119 s. ISBN 978-0273-74275-3. S. 501.
- ↑ BRAUER, GEORG. Handbook of Preparative Inorganic Chemistry V2.. 2. vyd. Burlington: Elsevier Science 1 online resource (882 pages) s. ISBN 9780323161299, ISBN 0323161294. OCLC 843200097 S. 200.
- ↑ EDWARDS, A. J.; TAYLOR, P. Crystal structure of antimony pentafluoride. Journal of the Chemical Society D: Chemical Communications. 1971, čís. 21, s. 1376. Dostupné online [cit. 2023-11-17]. ISSN 0577-6171. DOI 10.1039/c29710001376. (anglicky)
Literatura
[editovat | editovat zdroj]- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Fluorid antimoničný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid antimoničný na Wikimedia Commons




