Furosemid
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Furosemid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C12H11ClN2O5S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Hemmung des Na+-K+-2Cl−-Symporters | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 330,74 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
3,8; 7,5[1] | |||||||||||||||||||||
| Löslichkeit |
151±7 mg·l−1 (pH 4,5)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Furosemid ist ein Arzneistoff aus der Gruppe der Schleifendiuretika. Schleifendiuretika führen zur Ausscheidung großer Mengen von Gewebeflüssigkeit, indem sie in der Niere im aufsteigenden Teil der Henle-Schleife ein Transportprotein (den Na-K-2Cl Cotransporter) hemmen. Bei intravenöser Gabe des Medikaments sind Ausscheidungsmengen von bis zu 50 Liter pro Tag möglich. Es handelt sich um ein stark harntreibendes Mittel. Furosemid wurde im Jahre 1959 von Hoechst patentiert.[5][6]
Herstellung[Bearbeiten | Quelltext bearbeiten]
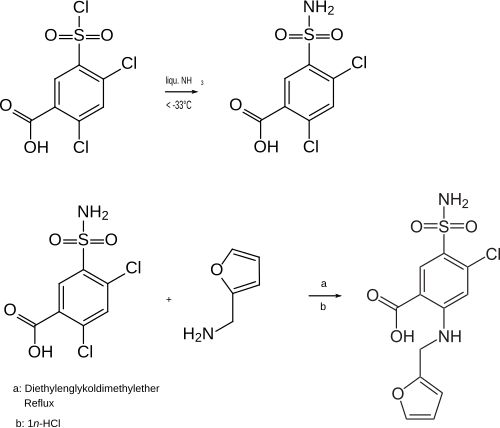
Im Rahmen eines Projekts zur Synthese substituierter Sulfanylanthranilsäuren wurde von Forschern der damaligen Farbwerke Hoechst AG unter anderem ein Furan-Derivat hergestellt, das dann den Freinamen Furosemid erhielt. Dazu wurde 2,4-Dichlorbenzoesäure sulfoniert. Das Sulfonsäurechlorid wurde mit flüssigem Ammoniak zum entsprechenden Sulfonsäureamid umgesetzt. Dieses fungierte als Edukt für die Herstellung verschiedener Amine. Durch Umsetzung mit Furfurylamin in siedendem Diethylenglykoldimethylether wurde Furosemid erhalten.[5][6]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Furosemid wird als weißes bis schwach gelbliches, geruchloses kristallines Pulver beschrieben.[7] Es existieren mehrere polymorphe Modifikationen.[8] Kristalle, die zur ersten Strukturanalyse gezüchtet wurden, gehörten zum Triklinen Kristallsystem und zeigten einen Schmelzpunkt von 214 °C.[9]
Die Substanz löst sich in Wasser, weniger in Ethanol. Daher kann Furosemid aus Ethanol/Wasser-Mischungen (wässriges Ethanol) umkristallisiert werden und bildet dann Kristalle vom Schmp. 206 °C.[10] Die Löslichkeit der Substanz in Wasser hängt vom pH-Wert ab. Zwischen pH 1,0 und 4,5 ist sie gering; ab pH 7,5 ist sie hoch. In wässriger Lösung existiert ein Gleichgewicht der aminosubstituierten Carbonsäure mit dem Zwitterion.[11][12] Furosemid bildet Alkalisalze, z. B. das Natriumsalz.[13]
Zahlreiche organische und biologisch wirksame Moleküle bilden Assoziate mit Furosemid; ihre Struktur ist kompliziert. Pharmakologisch wichtig sind Assoziate mit Proteinen, insbesondere die Bindung an Albumine[14] und an Serum-Proteine.[15]

Verwendung[Bearbeiten | Quelltext bearbeiten]
Wie oben erwähnt, werden Furosemid-Präparate in der Humanmedizin als Diuretikum und Blutdrucksenker verordnet. Was die perorale Einnahme betrifft, wird Furosemid im biopharmazeutischen Klassifizierungssystem auf Grund seiner schlechten Löslichkeit und schlechten Permeabilität in die Klasse IV eingeteilt. Die schlechte Permeabilität wird zum Teil durch die Affinität zu einer intestinalen Effluxpumpe bedingt, die aber bislang noch nicht genau beschrieben ist. Als Diuretikum wird Furosemid auch in der Veterinärmedizin verwendet. Im Sport wird Furosemid als Maskierungsmittel eingesetzt, da es hilft, eventuell vorhandene Spuren von eingenommenen Dopingmitteln aus dem Körper auszuschwemmen; es steht deshalb auf der Dopingliste.[16]
Indikationen[Bearbeiten | Quelltext bearbeiten]
Zugelassene Indikationen sind Bluthochdruck, Aszites und Ödeme (einschließlich Hirnödem) etwa infolge Herzinsuffizienz oder aufgrund von Leber-, Nierenerkrankungen oder von Verbrennungen, unter bestimmten Umständen auch drohendes Nierenversagen. Ferner wird Furosemid bei Hyperkaliämie eingesetzt, um überschüssiges Kalium auszuschwemmen.
Kontraindikationen[Bearbeiten | Quelltext bearbeiten]
Kontraindikationen sind: Hypovolämie, Anurie, Hypokaliämie, Einsatz in der Stillzeit und das hepatische Koma.
Zu Nebenwirkungen siehe Artikel Schleifendiuretikum.
Analytik[Bearbeiten | Quelltext bearbeiten]
Zur zuverlässigen qualitativen und quantitativen Bestimmung kommt nach angemessener Probenvorbereitung die Kopplung der Gaschromatographie oder der HPLC mit der Massenspektrometrie zum Einsatz.[17][18]
Handelsnamen[Bearbeiten | Quelltext bearbeiten]
Monopräparate
Diurapid (D), Furanthril (D), Furobeta (D), Furodrix (CH), Furogamma (D), Furon (A), Furorese (D), Furosal (D), Fursol (CH), Fusid (D), Jufurix (D), Lasix (D, A, CH), Oedemex (CH), diverse Generika (D, A, CH)
Kombinationspräparate
Betasemid (D), Diaphal (D), Furorese comp (D), Furo-Spirobene (A), Furospir (CH), Lasilacton (A, CH), Lasitace (A), Osyrol-Lasix (D), Spiro comp (D), Spiro-D (D)
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Eintrag zu Furosemid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 24. Juni 2014.
- ↑ K. Tsinman, A. Avdeef, O. Tsinman, D. Voloboy: Powder Dissolution Method for Estimating Rotating Disk Intrinsic Dissolution Rates of Low Solubility Drugs. In: Pharm Res, 26, 2009, S. 2093–2100. doi:10.1007/s11095-009-9921-3.
- ↑ a b Datenblatt Furosemide bei Sigma-Aldrich, abgerufen am 21. Juni 2022 (PDF).
- ↑ Eintrag zu Furosemide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Patent DE1122541B: Verfahren zur Herstellung von Sulfamyl-anthranilsäuren. Angemeldet am 28. Dezember 1959, veröffentlicht am 25. Januar 1962, Anmelder: Hoechst AG, Erfinder: Karl Sturm, Walter Siedel, Rudi Weyer.
- ↑ a b Patent US3058882B: N'-substituted-3-carboxy-6-halo-sulfanilamide and derivatives thereof. Angemeldet am 16. Oktober 1962, veröffentlicht am 16. Oktober 1979, Anmelder: Hoechst AG, Erfinder: Karl Sturm, Walter Siedel, Rudi Weyer.
- ↑ PubChem ID 3440
- ↑ Yoshihisa Matsuda, Etsuko Tatsumi: Physicochemical characterization of furosemide modifications. In: International Journal of Pharmaceutics, Jg. 1990, Bd. 60, Heft 1, S. 11–26. https://doi.org/10.1016/0378-5173(90)90185-7.
- ↑ J. Lamotte, H. Campsteyn, L. Dupont, M. Vermeire: Structure cristalline et moléculaire de l'acide furfurylamino-2 chloro-4 sulfamoyl-5 benzoïque, la furosémide (C12H11ClN2O5S). In: Acta Crystallographica B, Jg. 1978, Bd. B34, S. 1657–1661.
- ↑ The Merck Index, 11th edition, No. 4221, Seite 4217. Merck & Co., Inc., Rahway, N. J., U.S.A.
- ↑ Zitiert nach Diana Bach, Chana Vinkler, Israel R. Miller, S. Roy Caplan: Interaction of furosemide with lipid membranes. In: The Journal of membrane Biology. Jg. 1988, Bd. 101, S. 103–111. doi:10.1007/BF01872825
- ↑ Zitiert nach MI Said, AH Rageh, FAM Abdel-Aal: Fabrication of novel electrochemical sensors based on modification with different polymorphs of MnO 2 nanoparticles. Application to furosemide analysis . In: RSC Advances, Jg. 2018. pubs.rsc.orgRSC advances, 2018 - pubs.rsc.org
- ↑ PubChem ID 23673593.
- ↑ Masayasu Inoue, Kenji Okajima, Kazunobu Itoh, Yukio Ando, Nobukazu Watanabe, Tatsuomi Yasaka, Sumi Nagase, Yoshimasa Morino: Mechanism of furosemide resistance in analbuminemic rats and hypoalbuminemic patients. In: Kidney International, Jg. 1987, Bd. 32, Heft 2, S. 198–203, https://doi.org/10.1038/ki.1987.192
- ↑ G.M. Pacifici, A. Viani, G. Taddeucci-Brunelli: Serum Protein Binding of Furosemide in Newborn Infants and Children. In: Developmental Pharmacology and Therapeutics, Jg. 1987, Bd. 10, Heft 6, S. 413–421. https://doi.org/10.1159/000457773
- ↑ Dopingliste 2016 (PDF) WADA.
- ↑ C. Brunelli, C. Bicchi, A. Di Stilo, A. Salomone, M. Vincenti: High-speed gas chromatography in doping control: fast-GC and fast-GC/MS determination of beta-adrenoceptor ligands and diuretics. In: J Sep Sci. Band 29, Nr. 18, Dez 2006, S. 2765–2771. PMID 17305237
- ↑ D. I. Sora, S. Udrescu, F. Albu, V. David, A. Medvedovici: Analytical issues in HPLC/MS/MS simultaneous assay of furosemide, spironolactone and canrenone in human plasma samples. In: J Pharm Biomed Anal. Band 52, Nr. 5, 5. Sep 2010, S. 734–740. PMID 20307949