Hepatitis B
| Klassifikation nach ICD-10 | |
|---|---|
| B16.- | Akute Virushepatitis B |
| B16.0 | Akute Virushepatitis B mit Delta-Virus (Begleitinfektion) und mit Coma hepaticum |
| B16.1 | Akute Virushepatitis B mit Delta-Virus (Begleitinfektion) ohne Coma hepaticum |
| B16.2 | Akute Virushepatitis B ohne Delta-Virus mit Coma hepaticum |
| B16.9 | Akute Virushepatitis B ohne Delta-Virus und ohne Coma hepaticum |
| B18.0 | Chronische Virushepatitis B mit Delta-Virus |
| B18.1 | Chronische Virushepatitis B ohne Delta-Virus |
| ICD-10 online (WHO-Version 2019) | |
Die Hepatitis B (früher auch Serumhepatitis) ist eine durch das Hepatitis-B-Virus (HBV) verursachte Infektionskrankheit der Leber, die häufig akut (85–90 % der Fälle), gelegentlich auch chronisch verläuft. Mit etwa 350 Millionen Menschen, in deren Blut das Virus nachweisbar ist und bei denen somit das Virus dauerhaft als Infektionsquelle präsent ist, ist die Hepatitis B weltweit eine der häufigsten Virusinfektionen. Bei etwa einem Drittel der Weltbevölkerung sind als Zeichen einer ausgeheilten HBV-Infektion spezifische Antikörper nachweisbar.[1] Auf Basis der chronischen Leberentzündung kann eine Leberzirrhose sowie ein Leberzellkarzinom entstehen. Die Therapie einer chronischen Hepatitis B ist schwierig, daher ist die vorbeugende Impfung die wichtigste Maßnahme zur Vermeidung der Infektion und Verminderung der Virusträgerzahl.
Historie[Bearbeiten | Quelltext bearbeiten]
Ein Team des Max-Planck-Instituts für Menschheitsgeschichte in Jena und der Universität Kiel hat das Genom europäischer Hepatitis-B-Stämme aus der Steinzeit rekonstruiert. Erstmals konnte das Erbgut eines prähistorischen Virus gewonnen werden. Hepatitis B existiert in Europa seit mindestens 7000 Jahren. Herkunft und Entwicklungsgeschichte des Virus sind jedoch unbekannt. Die Forscher untersuchten Proben aus den Zähnen von 53 Individuen in Deutschland. Bei drei Individuen konnten Hepatitis-B-Viren entdeckt und das komplette Genom isoliert werden. Zwei stammen aus der Jungsteinzeit, der dritte Nachweis ist aus dem Mittelalter. Die Genomstruktur ist der des heutigen Hepatitis-B-Virus sehr ähnlich.[2]
Erreger[Bearbeiten | Quelltext bearbeiten]
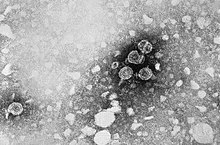
Der Erreger der Hepatitis B, das etwa 42 nm große Hepatitis-B-Virus, ist ein partiell doppelsträngiges DNA-Virus und gehört zur Familie der Hepadnaviridae. Zum Vergleich: Rote Blutkörperchen sind mit 7,5
Das ca. 3200 bp (Basenpaare) große Genom ist in ein ikosaedrisches Kapsid, das Hepatitis-B-Core-Protein (= HBV-Core-Antigen, HBcAg), verpackt. Es erfüllt eine ähnliche Funktion wie der Zellkern bei Mehrzellern. Das Kapsid ist von einer Virushülle umgeben, die aus einer zellulären Lipidmembran und eingelagerten Oberflächenproteinen des Virus aufgebaut ist. Von diesen Oberflächenproteinen (HBsAg, hepatitis B surface antigen) existieren drei unterschiedlich große Formen (L-, M- und S-HBsAg). Während der Vermehrung des HBV in den Hepatozyten[3] wird meist ein weiteres Protein in die Blutbahn abgegeben, das HBV-e-Antigen (HBeAg, „e“ wird als „exkretorisch“ in Bezug auf die lösliche Form des HBV-Core-Proteins[4] gedeutet[5]), ein Antigen ist ein von den Abwehrzellen als fremd erkanntes Molekül; das HBeAg ist ein frisch produziertes, dann gekürztes Hepatitis-B-Core-Protein (HBcAg), das von der infizierten Zelle ins Blut abgegeben wird. HBV ist nicht zytopathogen, so dass es in großen Mengen in Leberzellen produziert wird, ohne deren Funktion zu beeinflussen.[6]
Die meisten der Oberflächenproteine im Blut sind nicht am Aufbau der infektiösen Viren beteiligt (der sogenannten Dane-Partikel), sondern liegen als Filamente oder sphärische Partikel ohne Kapsid und DNA vor (bis zu 600
Die Therapie ist so schwierig, weil die Viren ihre Erbinformation in die DNA der Hepatozyten schreiben. Dafür nutzen sie RNA-Zwischenstufen und ähnlich dem HI-Virus Reverse Transkriptasen; das HBV ist daher eng mit den echten Retroviren verwandt. Eine Elimination des Hepatitis-B-Virus aus dem Organismus ist nicht möglich, die Viren-DNA wird fester Bestandteil der DNA der Leberzellen und teilt sich mit diesen. Nach überstandener akuter Infektion geht es in einen Ruhezustand über, aus dem es bei einer Immunschwäche (z. B. nach Organtransplantationen, Chemotherapie oder bei HIV-Infektion) reaktiviert werden kann.
Wegen der Ähnlichkeit zu Retroviren sind einige Arzneistoffe sowohl gegen HIV als auch Hepatitis B wirksam (die Nukleosidische Reverse-Transkriptase-Inhibitoren Lamivudin und Adefovir).
Die RNA-Zwischenstufe macht das HBV für ein DNA-Virus ungewöhnlich anpassungsfähig. Es bildet leicht Varianten (sogenannte Quasispezies), die das Immunsystem unterlaufen oder gegen antivirale Medikamente resistent sind.
Vom HBV sind acht Genotypen (Kladen) bekannt, die geographisch unterschiedlich verteilt sind. Typ 1 ist weltweit verbreitet, besonders aber in den Vereinigten Staaten, Europa und China. Die Typen 2 und 4 finden sich vor allem in Japan und Taiwan. In Südamerika ist der Genotyp 3 verbreitet. In Afrika sind dagegen die Typen 5, 6, 7 und 8 anzutreffen.[7]
Verbreitung[Bearbeiten | Quelltext bearbeiten]
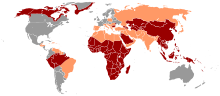
Das HBV kommt weltweit vor. Es ist endemisch in China, Südostasien, dem Nahen und Mittleren Osten, der Türkei und in großen Teilen Afrikas. Dank der seit einigen Jahren durchgeführten Impfkampagnen ist das Vorkommen chronischer Virusträger in Nord- und Westeuropa, den USA, Kanada, Mexiko und südlichen Regionen Südamerikas auf unter ein Prozent gefallen.
In Deutschland war in einer von 2008 bis 2011 durchgeführten, bevölkerungsrepräsentativen Untersuchung an über 7000 Erwachsenen im Alter zwischen 18 und 79 Jahren ein Anteil von 3,9 % als immun nach abgeklungener Hepatitis-B-Infektion einzustufen, bei 0,9 % war die Infektion abgeklungen, der Immunstatus jedoch unklar, 20,1 % waren immun nach einer Impfung, 0,5 % zeigten Anzeichen einer akuten oder chronischen Hepatitis B-Erkrankung.[8]
Die offiziellen Fallzahlen des Robert Koch-Instituts können der Auflistung unten entnommen werden, wobei die wirkliche Zahl wesentlich höher anzusetzen ist. Gehäuft ist in Deutschland eine Trägerschaft bei intravenös Drogenabhängigen, Homosexuellen und Personen aus dem arabischen Raum und der Türkei zu finden. Bei letzten handelt es sich oft um angeborene Infektionen. In Ost- und Südeuropa sind bis zu acht Prozent der Bevölkerung chronisch HBV-infiziert. Die Hälfte aller chronischen Virusträger in Deutschland haben einen Migrationshintergrund.
Die beim RKI für Deutschland gemeldeten Fallzahlen haben sich seit dem Jahr 2000 folgendermaßen entwickelt:
| Jahr | gemeldete Fallzahlen |
|---|---|
| 1994 | 5135[9] |
| 2000 | 4506[10] |
| 2001 | 2427[11] |
| 2002 | 1425[12] |
| 2003 | 1308[13] |
| 2004 | 1258[14] |
| 2005 | 1236[15] |
| 2006 | 1186[16] |
| 2007 | 1004[17] |
| 2008 | 817[18] |
| 2009 | 746[19] |
| 2010 | 768[20] |
| 2011 | 811[21] |
| 2012 | 675[22] |
| 2013 | 687[23] |
| 2014 | 755[24] |
| 2015 | 1943[25] |
| 2016 | 3034[26] |
| 2017 | 3609[27] |
| 2018 | 4503[28] |
| 2019 | 8941[29] / 6386[28] |
| 2020 | 6802[30] / 6695[29] |
| 2021 | 8545[31] / 7892[30] |
| 2022 | 15986[31] |
Die Darstellung von Grafiken ist aktuell auf Grund eines Sicherheitsproblems deaktiviert.
Übertragung[Bearbeiten | Quelltext bearbeiten]
Die Infektion mit dem HBV erfolgt meist parenteral, d. h. durch Blut oder andere kontaminierte Körperflüssigkeiten eines infizierten, HBsAg-positiven Trägers über Verletzungen oder Sexualkontakt. Die Infektiosität eines Virusträgers ist abhängig von der Viruskonzentration im Blut; bei sogenannten hochvirämischen Trägern (107 bis zu 1010 HBV-Genome/ml) finden sich infektiöse Viren auch in Urin, Speichel, Samenflüssigkeit, Tränensekret, Galle und Muttermilch.
Die Eintrittspforten sind meist kleinste Verletzungen der Haut oder Schleimhaut. Daher gilt als Risikofaktor auch der ungeschützte Geschlechtsverkehr. Unter Kleinkindern kann die Infektion auch durch Kratzen oder Beißen weitergegeben werden. Auch Gegenstände des täglichen Lebens, wie zum Beispiel Rasierapparate oder Nagelscheren, mit denen man sich häufig geringfügig verletzt, können das HBV übertragen. In Ländern, in denen noch das Rasieren beim Barbier weit verbreitet ist, findet sich meist auch eine erhöhte Häufigkeit von HBV-Infektionen. Weitere wichtige Übertragungsmöglichkeiten sind auch größere Verletzungen mit Blutkontakt z. B. bei intravenösem Drogenkonsum, Tätowierung und Piercing. Im medizinischen Bereich kann HBV durch invasive, operative Eingriffe und Verletzungen übertragen werden, so von unerkannten HBsAg-Trägern auf Patienten oder von nicht-getesteten Patienten auf medizinisches oder zahnärztliches Personal. Die Übertragung von HBV durch Blut und Blutprodukte bei einer Transfusion ist seit der Testung von Blutspenden auf anti-HBc, HBsAg und HBV-DNA in Deutschland sehr selten geworden.
In Endemiegebieten ist der wichtigste Übertragungsweg die vertikale Infektion von einer HBsAg-positiven Mutter unter der Geburt (perinatal) auf das Kind. Die perinatale Infektion hat zu 90 % eine chronische Infektion des Kindes zur Folge.
Das Risiko einer Ansteckung durch eine Nadelstichverletzung mit bekannt HBsAg-positivem Indexpatient liegt bei etwa 10–30 %. Dieses Risiko ist sehr abhängig von der Viruskonzentration, unterhalb von 105 HBV-Genomen/ml ist eine solche Übertragung im medizinischen Bereich nicht nachgewiesen worden. Diese z. B. in Großbritannien bereits festgelegte Grenze hat große Bedeutung bei der Beschäftigung von HBsAg-Trägern im medizinischen Bereich.
Klinischer Verlauf[Bearbeiten | Quelltext bearbeiten]
Akute Hepatitis B[Bearbeiten | Quelltext bearbeiten]
Etwa 2/3 aller Infektionen verlaufen ohne klinische Anzeichen (asymptomatisch), d. h. nur etwa ein Drittel der Infizierten zeigen nach einer Inkubationszeit von ein bis sechs Monaten die klassischen Hepatitiszeichen wie Gelbfärbung der Haut und der Skleren (Ikterus), dunklen Urin, Gliederschmerzen, Schmerzen im Oberbauch, Übelkeit, Erbrechen und Durchfall. Häufig wird nach asymptomatischen Verläufen eine leichte Abgeschlagenheit angegeben oder eine Erhöhung der Leberenzyme (Transaminasen) wird zufällig entdeckt; eine solche Infektion kann meist nur durch die Serologie erkannt werden.
In der Regel heilt eine unkomplizierte akute Hepatitis B nach zwei bis sechs Wochen klinisch aus, der Nachweis von Antikörpern gegen das HBsAg (anti-HBs) zeigt dies an. Mit dem Verschwinden des HBsAg und dem Auftauchen von anti-HBs (Serokonversion) gilt die Ansteckungsgefahr als überwunden.
Selten kann eine akute Hepatitis B einen schwereren Verlauf mit hoher Virämie nehmen, bei dem es zu einer Beeinträchtigung der Blutgerinnung und zu Schädigungen des Gehirns (Enzephalopathie) kommt; hier wird eine Therapie mit einem Nukleosidanalogon (z. B. Lamivudin) oder Nukleotidanalogon[32] empfohlen. Im schwersten Fall kommt es bei rund 1 % der symptomatischen Verläufe zu einem lebensbedrohlichen Verlauf (in Stunden bis wenigen Tagen), der sogenannten fulminanten Hepatitis.[6] In diesem Fall gelten das rasche Verschwinden des HBsAg und eine Schrumpfung der Leber als ungünstige Zeichen; eine medikamentöse Therapie und intensivmedizinische Betreuung mit der Möglichkeit einer Lebertransplantation sind geboten. Die Verabreichung von Interferon ist bei jeder Form der akuten Hepatitis B kontraindiziert.
Chronische Hepatitis B[Bearbeiten | Quelltext bearbeiten]
In vielen Fällen verläuft die Infektion mit dem Hepatitis-B-Virus unbemerkt und ohne Symptome. Definitionsgemäß spricht man von einer chronischen Hepatitis B, wenn die Symptome einer durch HBV verursachten Leberentzündung sowie entsprechende virale Marker (positiver HBsAg-Befund[32]) länger als sechs Monate ununterbrochen bestehen (persistieren). Die Chronifizierung ist die Hauptkomplikation einer Hepatitis B, die Häufigkeit hängt vom Alter zum Zeitpunkt der Infektion ab.[6] Sie kann sich entweder im Anschluss an eine akute Hepatitis B entwickeln oder auch primär chronisch verlaufen. Die Chronifizierungsrate ist bei Neugeborenen am höchsten und nimmt mit steigendem Alter stetig ab. Neugeborene werden bei einer Infektion in über 90 % der Fälle zu chronischen Virusträgern. Noch bei vierjährigen Patienten verläuft die Hälfte aller Infektionen chronisch.[6] Ältere Kinder, Jugendliche oder Erwachsene chronifizieren bei etwa 3–5 % der Fälle.
Bei etwa einem Viertel aller chronischen Hepatitis-B-Erkrankungen ist ein sich im Schweregrad steigernder (progredienter) Krankheitsverlauf zu beobachten, der dann häufig zu erheblichen Folgeschäden wie beispielsweise zu einem Leberzellkarzinom oder Leberzirrhose führt.[6] Spätestens bei Auftreten von Bewusstseinsveränderungen (sogenannte Hepatische Enzephalopathie) ist die Verlegung in ein Zentrum für Lebererkrankungen angebracht.
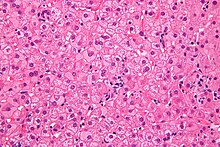
Histopathologisch charakteristisch für eine chronische Hepatitis-B-Infektion sind sogenannte Milchglashepatozyten.[33] Aufgrund der Hyperplasie des glatten Endoplasmatischen Retikulums (sER, von englisch smooth), induziert durch eine massive Vermehrung des Virushüllmaterials (HBs-Antigen), erscheint das Zytoplasma dieser Leberzellen unter dem Mikroskop blass-eosinophil, feinstkörnig, homogen-milchglasartig.[34] Demgegenüber müssen bestimmte andere Formen der Hyperplasie des sER abgegrenzt werden, wie sie durch Medikamenteninduktion (Disulfiram, Barbiturate) oder andere Krankheitsbilder (z. B. Lafora-Krankheit) entstehen können. Im akuten Stadium der Hepatitis B sind Milchglashepatozyten nicht nachweisbar.[33]
Bei einer bösartigen Verlaufsform nach Hepatitis-B-Infektion besteht eine Letalität von 0,5–1 %. Etwa fünf Prozent der HBV-Infizierten sind zusätzlich an Hepatitis D erkrankt.
HBV gehört zusammen mit dem Epstein-Barr-Virus (EBV), dem Hepatitis-C-Virus (HCV), dem Humanen Papillomvirus (HPV), dem Humanen T-lymphotropen Virus 1 (HTLV-1) und dem Humanen Herpesvirus 8 (HHV-8, auch Kaposi-Sarkom-Herpesvirus, KSHV) zu einer Gruppe von humanen Viren, die weltweit für 10 bis 15 Prozent aller Krebserkrankungen verantwortlich sind.[35] Man schätzt, dass ca. 50 % der Leberkrebserkrankungen auf HBV zurückzuführen sind.[36] Eine Kohortenstudie in China mit ca. 500.000 Teilnehmern hat gezeigt, dass eine chronische Hepatitis-B-Erkrankung auch das Risiko für andere Krebserkrankungen, insbesondere Krebserkrankungen im Gastrointestinaltrakt, erhöhen kann.[37]
Reaktivierung[Bearbeiten | Quelltext bearbeiten]
Durch neue Therapien bei der Behandlung von Leukämie und zur Immunsuppression nach einer Organtransplantation wurde in den letzten Jahren in einzelnen Fällen eine Reaktivierung einer alten, klinisch ausgeheilten HBV-Infektion beobachtet. Auch wurden Reaktivierungen von HBV bei AIDS im fortgeschrittenen Stadium (C3) beschrieben. Die HBV-Infektion lag in einigen Fällen der Reaktivierung bereits Jahrzehnte zurück, und die Patienten hatten vorher das klassische serologische Muster einer alten Infektion (anti-HBc und anti-HBs positiv, siehe Diagnostik). Eine solche Reaktivierung verläuft oft sehr schwer, insbesondere wenn nach erfolgter Reaktivierung die Immunsuppression reduziert wird und durch die dann erfolgende Immunabwehr die Leber wie bei einer fulminanten Hepatitis rasch zerstört wird. Das Auftauchen solcher Symptome nach Reduzierung der Immunsuppression (z. B. bei Beendigung einer Chemotherapie oder bei erfolgreicher HIV-Therapie) wird auch Immunrekonstitutions-Syndrom genannt.
Durch eine Reaktivierung besonders gefährdet sind Patienten nach Nierentransplantation, Knochenmark-Transplantation und Patienten mit Akuter Myeloischer Leukämie. Eine Behandlung mit einem Nukleosidanalogon für mehrere Wochen bis Monate ist bei einer nachgewiesenen Reaktivierung geboten.
Das Phänomen einer Reaktivierung verdeutlicht noch einmal die Tatsache, dass das HBV ähnlich wie ein echtes Retrovirus in einen Ruhezustand übergehen kann und nicht aus allen Zellen eliminiert wird. Insgesamt ist die Reaktivierung jedoch ein sehr seltenes Ereignis.
Diagnose[Bearbeiten | Quelltext bearbeiten]
Man unterscheidet bei der Hepatitis B hauptsächlich zwei Verlaufsformen, die akute Hepatitis B, die nach spätestens einem halben Jahr völlig ausgeheilt ist, und die chronische Hepatitis B. Die chronische Hepatitis B entsteht aus einer nicht ausgeheilten akuten, kann jahrzehntelang dauern und eine Leberzirrhose oder ein Hepatozelluläres Carcinom (HCC) zur Folge haben. Die Sicherung der jeweiligen Diagnose erfolgt über drei Hauptbestandteile, nach denen gesucht wird:
- Virus-Antigene (also das Virus selbst oder dessen Proteine): Findet man noch Virus-Antigene (HBs-Ag, HBe-Ag), dann ist die Infektion nicht überstanden: Es wird eine akute oder chronische Hepatitis B vorliegen oder, im günstigsten Fall, wenn nur HBs-Ag nachweisbar ist und der Patient sonst gesund ist, ein sog. HBs-Träger-Status. Patienten mit HBe-Ag im Blut sind hoch ansteckend; aber auch bei alleinigem HBs-Ag im Blut besteht Ansteckungsgefahr.
- Antikörper (die unsere Abwehr dagegen bildet): Anti-HBs sind Zeichen einer Ausheilung. Man findet sie auch nach erfolgreicher Hepatitis-B-Impfung. Sie zeigen also eine Immunität gegen Hepatitis B an. Anti-HBc-IgM sprechen für das Vorliegen einer akuten Hepatitis. Anti-HBc-IgG findet man sowohl im späteren akuten Stadium wie auch nach Abheilung. Anti-HBe können in der Heilungsphase einer akuten Hepatitis auftreten. Ihr Auftreten bei chronischer Hepatitis zeigt eine Verbesserung und eine verminderte Ansteckungsgefahr an.
- Virus-DNA (Desoxyribonukleinsäure, also Erbsubstanz des Virus): Früher hat man die DNA-Messung bei Hepatitis B zur Diagnose unklarer Fälle und zur Abschätzung der Ansteckungsgefahr eingesetzt. Heute ist die Messung auch für die Diagnose und Beobachtung der chronischen Hepatitis wichtig. Wenig Virus-DNA im Blut spricht für eine ruhende Infektion, viel DNA für eine aktive chronische Hepatitis.
| anti-HBc | anti-HBs | HBs-Antigen | anti-HBe | HBe-Antigen | HBV-DNA | Interpretation |
|---|---|---|---|---|---|---|
| neg. | pos. | (neg.) | (neg.) | (neg.) | (neg.) | Zustand nach Impfung |
| pos. | pos. | (neg.) | (neg./pos.) | (neg.) | (neg.) | alte, klinisch ausgeheilte Infektion |
| pos. | (neg.) | pos. | neg. | pos. | hochpos. | hochvirämische Infektion |
| pos. | (neg.) | pos. | pos. | neg. | pos. | niedrigvirämische Infektion |
| pos. | (neg.) | pos. | neg. | neg. | hochpos. | „HBe-Minus-Mutante“, prä-Core-Mutation |
| anti-HBc | anti-HBs | HBs-Antigen | anti-HBe | HBe-Antigen | HBV-DNA | Interpretation |
|---|---|---|---|---|---|---|
| pos. | neg. | neg. | neg. | neg. | neg. | „isolierte anti-HBc-Positivität“: unspezifische Testreaktion oder sehr alte, ausgeheilte Infektion |
| pos. | neg. | neg. | pos. | neg. | neg. | alte, ausgeheilte Infektion mit Verlust des anti-HBs oder unspezifische Kreuzreaktivität |
| neg. | pos. | pos. | neg. | neg. | neg. | meist unspezifische Testreaktion des HBsAg-Tests oder sehr seltener Befund wenige Tage nach einer wiederholten Impfung |
| neg. | neg. | pos. | neg. | neg. | pos. | fehlendes anti-HBc: Häufige Konstellation bei Infektion eines Nicht-Immunkompetenten oder bei angeborener Infektion |
Der Gemeinsame Bundesausschuss hat festgelegt, dass die Diagnostik der infektiösen Hepatitisformen nicht von der bekannten Zugehörigkeit zu Risikogruppen abhängig gemacht werden soll. Vielen Patienten ist ihr Risikostatus nicht bewusst oder sie wollen keiner Risikogruppe angehören. Deshalb haben seit dem 1. Oktober 2021 alle gesetzlich versicherten Personen das Recht, sich im Rahmen des Check-up 35 einmalig auf Hepatitis-C und Hepatitis-B untersuchen zu lassen.[38]
Therapie[Bearbeiten | Quelltext bearbeiten]
Im Akutstadium (d. h. in den ersten Monaten nach der Infektion) wird eine Hepatitis B gewöhnlich nur symptomatisch therapiert, da die Erkrankung in 90–95 % der Fälle von selbst ausheilt.
Für eine chronische Hepatitis B stehen zwei Medikamentenklassen zur Verfügung:
- Interferon alpha (2-a oder 2-b), bevorzugt pegyliertes Interferon (Peginterferon) alpha 2-a, das einmal wöchentlich gespritzt wird. Interferone regen das Immunsystem an, damit dieses effektiver gegen das Virus kämpft.
- Nukleosid- bzw. Nukleotidanaloga, die täglich als Tablette eingenommen werden. Dazu gehören Lamivudin, Adefovir, Entecavir, Telbivudin und Tenofovir. Diese Wirkstoffe behindern das Virus bei der Vermehrung.
Weitere Wirkstoffe werden in Studien geprüft. Diese Therapien sind allerdings nicht kurativ, es ist also keine vollständige Elimination des Virus zu erwarten. Das Therapieziel ist vielmehr, den Verlauf der chronischen Hepatitis B abzumildern und das Risiko von Spätfolgen zu senken. Selten (bis zu drei Prozent) kann unter der Therapie mit (Peg-)Interferon oder den anderen Wirkstoffen auch das HBsAg aus dem Blut verschwinden und als Immunreaktion anti-HBs-Antikörper auftreten, was einer Heilung gleichkommt.
Welcher Patient wann therapiert werden muss und mit welchem Medikament, ist von Fall zu Fall unterschiedlich. Bei sehr mildem Verlauf wird eine chronische Hepatitis B meist nur beobachtet. Bei Hinweisen auf eine Schädigung der Leber oder anderen Risikofaktoren ist eine Therapie jedoch sehr wichtig (Stand: August 2008). Dies sollte im Einzelfall fachärztlich beurteilt werden.
Behandelt werden muss die chronisch aktive Hepatitis B, bei der die HB-Viruslast größer als 2000 IU/ml ist, eine Transaminasen-Erhöhung (ein Leberfunktionsparameter) um mehr als das Doppelte stattgefunden hat, sich histologisch eine Entzündungsaktivität zeigt und sonografisch, bioptisch oder durch Fibroscan eine Fibrose oder Leberzirrhose erkennbar ist. Bestehen diese diagnostischen Kriterien nicht, spricht man bei den Betroffenen von inaktiven Trägern und es ist zunächst nur eine Beobachtung erforderlich.[39]
Impfung[Bearbeiten | Quelltext bearbeiten]
Gegen Hepatitis B kann aktiv und passiv geimpft werden. Eine präexpositionelle Gabe an gefährdete Personen findet dagegen nicht mehr statt.[6]
Aktive Immunisierung[Bearbeiten | Quelltext bearbeiten]
Die aktive Impfung besteht aus einem gentechnisch in Hefezellen exprimierten Bestandteil der Virushülle, dem HBs-Antigen. Aktiv wird der Körper, der gegen die Fremdstoffe Abwehrmoleküle (Immunglobuline) bildet, um sie zu zerstören. Nach drei Impfungen kennen die Immunzellen den Virusbestandteil und können es bei einer echten Infektion bekämpfen. Entgegen anderen Meinungen werden bei der Hepatitis-B-Impfung keine echten Viren verabreicht.
Zur Grundimmunisierung wird die Impfung dreimal durchgeführt:[6]
- Impfung (Woche Null)
- Impfung (etwa einen 1 Monat später)
- Impfung (ein halbes Jahr bis ein Jahr nach erster Impfung)
Eine etwas höhere Serokonversionsrate innerhalb der ersten Monate nach Impfung lässt sich durch ein anderes Impfschema erreichen. Bei diesem werden die ersten drei Impfungen alle 4 Wochen durchgeführt, abschließend erfolgt ein Jahr nach der ersten Impfung eine vierte Impfung.[6]
Zur Kontrolle des Impferfolgs sollte 4–8 Wochen nach Beendigung der Grundimmunisierung Anti-HBs bestimmt werden (erfolgreiche Impfung: Anti-HBs ≥ 100 IE/l). Nach erfolgreicher Impfung sind keine weiteren Auffrischimpfungen erforderlich (Ausnahme: Patienten mit Immundefizienz, ggf. Personen mit besonders hohem individuellem Expositionsrisiko).[40] Die Anzahl der Non-Responder liegt bei etwa 5 Prozent.[6]
Da man sich nur mit Hepatitis D anstecken kann, wenn schon eine Hepatitis B vorliegt, schützt die Hepatitis-B-Impfung auch vor Hepatitis-D-Viren. Darüber hinaus gibt es einen Kombinationsimpfstoff, der auch gegen Hepatitis A schützt.
Die Weltgesundheitsorganisation forderte 1992 alle Mitgliedsstaaten dazu auf, die Hepatitis-B-Impfung in nationale Routineimpfprogramme aufzunehmen.[41] In Taiwan hat die universelle HBV-Impfung die Rate an Leberkrebs erheblich gesenkt.[42]
Passive Immunprophylaxe und Simultanimpfung[Bearbeiten | Quelltext bearbeiten]
Bei der passiven Impfung werden Hyperimmunglobuline (HGIB) gespritzt; fertige Immunglobuline, die dem Immunsystem helfen, die Viren zu bekämpfen. Diese wird zusammen mit aktivem Impfstoff nach Kontakt mit infiziertem Material (Postexpositionsprophylaxe, bes. im Krankenhaus: Nadelverletzungen, Schleimhautkontakt, bluthaltige Sekrete usw., wobei eine aktive Impfung erfolgt, wenn anti-HBs unter 100 IE/l und die Gabe von Immunglobulin, wenn anti-HBs unter 10 IE/l[43]) verabreicht. Bei dieser sog. passiv-aktiven Simultanprophylaxe, auch Simultanimpfung, sollen die HGIBs innerhalb der ersten vier Stunden, höchstens 48 Stunden gegeben werden.[6]
Auch bei Neugeborenen Hepatitis-B-positiver Mütter soll bis 12 Stunden nach Kontakt bzw. Geburt die Gabe von Immunglobulinen erfolgen.[44] Das (perinatale) Infektionsrisiko dieser Mütter beträgt etwa 90 %.[6] Dieser Impfschutz wird bei Neugeborenen nach dem normalen Impfschema (0. – 1. – 6. Monat) vervollständigt. Durch die Simultanimpfung wird eine Immunantwort bei über 90 % der Impflinge erreicht.[6]
Deutschland[Bearbeiten | Quelltext bearbeiten]
Eine Impfung (aktive Immunisierung) wird bei allen Säuglingen und Kindern von der Ständigen Impfkommission (STIKO) empfohlen, und zwar seit 1995.[45]
Wie auch in einigen anderen europäischen Ländern wird die Grundimmunisierung seit 2020 durch ein sogenanntes „2+1-Schema“ realisiert (Impfung im 2. und 4. Monat, abschließend im 11. Monat), falls die einzelnen Impfungen zu den empfohlenen Zeitpunkten durchgeführt und das Impfschema rechtzeitig abgeschlossen wird.[46] Bei der Impfung handelt es sich in der Regel um einen Kombinationsimpfstoff, z. B. einen hexavalenten. Bei Frühgeborenen wird eine zusätzliche Impfstoffdosis im Alter von 3 Monaten empfohlen (sogenanntes „3+1-Schema“).
Außerdem sollten Personen in Heil- und Pflegeberufen sowie Bestatter, Thanatologen und Leichenwäscher, Mitarbeiter in der Pathologie, Dialysepatienten, Promiskuitive, Drogenabhängige und Reisende in Risikogebiete nicht auf den Impfschutz verzichten. Die Hepatitis-B-Impfung ist Kassenleistung bei Kindern, Jugendlichen und Personen, die einer Risikogruppe angehören; einige Krankenkassen erstatten die Kosten einer Reiseimpfung als Satzungsleistung.
Österreich[Bearbeiten | Quelltext bearbeiten]
In Österreich wird die Grundimmunisierung bei allen Säuglingen ab dem dritten Lebensmonat – in der Regel mit einem sechsfach kombinierten Impfstoff – durchgeführt, ansonsten wird bei den bislang ungeimpften Kindern die Grundimmunisierung im Rahmen der Schulimpfung im elften Lebensjahr durchgeführt. Es wird angenommen, dass nach einer kompletten Grundimmunisierung (bei Respondern) der Schutz vor Komplikationen einer Hepatitis-B-Infektion durch die Reaktivierung der spezifischen Gedächtniszellen gewährleistet ist, auch wenn die Impfantikörper verschwunden sind.[47] Auf die Schulimpfung gegen Hepatitis B dürfte somit verzichtet werden, wenn die ersten geimpften Säuglinge dieses Alter erreicht haben, da bei jungen Impflingen eine spätere Auffrischungsimpfung derzeit von Experten nicht empfohlen wird.
Nebenwirkungen[Bearbeiten | Quelltext bearbeiten]
Generell wird die Impfung sehr gut vertragen.[6] Gelegentlich kommt es zu Rötungen, Schwellungen oder leichtem Schmerz an der Impfstelle. Seltener sind Allgemeinreaktionen wie Fieber, Kopfschmerzen, Abgeschlagenheit und Gelenkbeschwerden. Vereinzelt wurden auch anaphylaktische oder allergische Reaktionen beobachtet (Vaskulitis, Nesselsucht, Blutdruckabfall).
Ein Kausalzusammenhang mit neurologischen Erkrankungen (z. B. Guillain-Barré-Syndrom, Enzephalitis, Optikusneuritis) oder anderen Symptomen (z. B. Thrombozytopenie, Arthritis, Erythema multiforme) wurde nie bestätigt; es liegen Einzelfallberichte vor, bei denen ein zufälliges zeitliches Zusammentreffen vermutet wird.[48]
Ob eine unsymptomatische Multiple Sklerose (MS) durch die HBV-Impfung ausgelöst werden kann, wurde wiederholt in Studien und Einzelfallberichten diskutiert. Auslöser waren mehrere Fälle von MS bei Jugendlichen in Frankreich im Jahre 1997 und 1998, die zeitlich nach HBV-Impfungen beobachtet wurden.[6] Ein ursächlicher Zusammenhang ist aber wissenschaftlich nicht belegt.[48] Eine Studie aus dem Jahr 2004 konnte angeblich ein dreifach erhöhtes MS-Risiko durch die HBV-Impfung feststellen;[49] sie wurde aber (u. a. von der Weltgesundheitsorganisation WHO) wegen methodischer Fehler als irreführend und nicht aussagekräftig kritisiert: Bei der Studie wurden ausschließlich MS-Patienten gefragt, wie viele von ihnen in den drei Jahren vor ihrer MS-Diagnose gegen Hepatitis B geimpft wurden (dies traf nur auf elf von ursprünglich 713 MS-Patienten zu). Es wurde nicht untersucht, wie viele Gesunde gegen Hepatitis B geimpft worden waren und nicht an MS erkrankten, um einen Vergleichsrahmen zu schaffen. Eine Vielzahl anderer Studien mit großen Patientenkollektiven zeigt keinen kausalen Zusammenhang zwischen Impfung und dem Auftreten von MS bzw. einem erhöhten Risiko an Schüben.[50][51][52][53] Die Auswertung von Versichertendaten aus Bayern hat im Gegenteil ergeben, dass Personen, die an MS erkrankt sind, fünf Jahre vor dieser Diagnose seltener geimpft wurden als eine Vergleichsgruppe ohne MS.[54]
Kontraindikationen[Bearbeiten | Quelltext bearbeiten]
Eine spezielle Kontraindikation gegen die HBV-Impfung ist nicht bekannt.[6] Schwangere können geimpft werden; im ersten Trimester sollte dies aber nur dann erfolgen, falls die Impfung erforderlich ist.[55]
Meldepflicht[Bearbeiten | Quelltext bearbeiten]
In Deutschland ist jede akute Virushepatitis (also auch akute Hepatitis B) gemäß § 6 Infektionsschutzgesetz (IfSG) namentlich meldepflichtig. Dies betrifft den Verdacht einer Erkrankung, die Erkrankung sowie den Tod. Zudem ist auch jeder Nachweis des Hepatitis-B-Virus nach § 7 IfSG namentlich meldepflichtig.
In Österreich sind nach § 1 Abs. 1 Epidemiegesetz 1950 Verdachts-, Erkrankungs- und Todesfälle an infektiöser Hepatitis (Hepatitis A, B, C, D, E), also auch Hepatitis B, anzeigepflichtig.
Auch in der Schweiz unterliegt Hepatitis B der Meldepflicht und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. Meldekritien für diese Meldung durch Ärzte, Spitäler usw. sind ein positiver laboranalytischer Befund und die Aufforderung durch die Kantonsärztin oder den Kantonsarzt, den Fall zu melden. Ein positiver laboranalytischer Befund für den Hepatitis-B-Virus ist von Laboratorien nach Anhang 3 der oben genannten Verordnung des EDI zu melden.
Literatur[Bearbeiten | Quelltext bearbeiten]
- S3-Leitlinie Hepatitis-B-Virusinfektion – Prophylaxe, Diagnostik und Therapie der Deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten (DGVS). In: AWMF online (Stand 31. Januar 2011)
- Baruch S. Blumberg: Hepatitis B: the hunt for a killer virus. Princeton 2002.
- Archäologie in Deutschland (AiD) 04/2018, S. 4.
- Hartwig Klinker: Infektionen durch Viren. In: Marianne Abele-Horn (Hrsg.): Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 297–299.
- Wolfram H. Gerlich: Medical Virology of Hepatitis B: how it began and where we are now. In: Virology Journal. Band 10, 2013, S. 239, doi:10.1186/1743-422X-10-239.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Hepatitis B – Informationen des Robert Koch-Instituts
- Webseite des Nationalen Referenzzentrums für Hepatitis-B- und -D-Viren (Institut für Medizinische Virologie Gießen)
- Kompetenznetz Hepatitis
- Impfempfehlung der Stiko. (PDF; 211 kB) Epidemiologisches Bulletin 36/2013
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Management and treatment of patients with hepatitis B. doi:10.1016/S0213-005X(16)30219-1.
- ↑ Ben Krause-Kyora et al.: Neolithic and medieval virus genomes reveal complex evolution of hepatitis B. In: eLife. Band 7, 10. Mai 2018, doi:10.7554/eLife.36666, PMID 29745896, PMC 6008052 (freier Volltext).
- ↑ Gholamreza Darai, Michaela Handermann u. a.: Lexikon Der Infektionskrankheiten. 4. Auflage. Springer, 2011, ISBN 3-642-17158-3, S. 372. eingeschränkte Vorschau in der Google-Buchsuche
- ↑ Ärztezeitung: Heilung nach Hepatitis-B-Therapie?.
- ↑ fälschlich auch als „envelope“ und „early“; vgl. dazu Medical Virology of Hepatitis B: how it began and where we are now. PMC 3729363 (freier Volltext)
- ↑ a b c d e f g h i j k l m n o Wolfgang Jilg: Hepatitis B. In: Heinz Spiess, Ulrich Heininger, Wolfgang Jilg (Hrsg.): Impfkompendium. 8. Auflage. Georg Thieme Verlag, 2015, ISBN 978-3-13-498908-3, S. 185 ff.
- ↑ A. Erhardt, W. H. Gerlich: Hepatitis- B-Virus. In: Wolfram H. Gerlich (Hrsg.): Medizinische Virologie. 2. Auflage, Georg Thieme Verlag, 2010, ISBN 3-13-113962-5, S. 373. eingeschränkte Vorschau in der Google-Buchsuche
- ↑ C. Poethko-Müller et al.: Die Seroepidemiologie der Hepatitis A, B und C in Deutschland Ergebnisse der Studie zur Gesundheit Erwachsener in Deutschland (DEGS1). (PDF; 610 kB) In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz 56: S. 707–715 (2013).
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 2,6 MB) 23. Januar 1996.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 119 kB) 18. Januar 2002.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 113 kB) 17. Januar 2003.
- ↑ Epidemiologisches Bulletin Nr. 2 des RKI (PDF; 172 kB) 16. Januar 2004.
- ↑ Epidemiologisches Bulletin Nr. 2 des RKI (PDF) 14. Januar 2005.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 139 kB) 20. Januar 2006.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 111 kB) 19. Januar 2007.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 107 kB) 18. Januar 2008.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 124 kB) 19. Januar 2009.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 116 kB) 25. Januar 2010.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 113 kB) 24. Januar 2011.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 121 kB) 23. Januar 2012.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 117 kB) 21. Januar 2013.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 116 kB) 20. Januar 2014.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 116 kB) 19. Januar 2015.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 307 kB) 20. Januar 2016.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 128 kB) 18. Januar 2017.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 238 kB) 17. Januar 2018.
- ↑ Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 238 kB) 17. Januar 2018.
- ↑ a b Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 2,5 MB) 16. Januar 2020.
- ↑ a b Epidemiologisches Bulletin 1/2021 (PDF; 2,7 MB)
- ↑ a b Epidemiologisches Bulletin 1/2022 (PDF; 3,5 MB)
- ↑ a b Epidemiologisches Bulletin 1/2023 (rki.de) (PDF; 3 MB) 5. Januar 2023.
- ↑ a b Hartwig Klinker: Akute Hepatitis B. 2009, S. 297.
- ↑ a b Helmut Denk, H. P. Dienes et al.: Pathologie der Leber und Gallenwege. Springer, Berlin 2014, ISBN 978-3-642-62991-4.
- ↑ Henryk Dancygier: Klinische Hepatologie: Grundlagen, Diagnostik und Therapie hepatobiliärer Erkrankungen. Springer, Berlin 2003, ISBN 3-540-67559-0.
- ↑ D. Martin, J. S. Gutkind: Human tumor-associated viruses and new insights into the molecular mechanisms of cancer. In: Oncogene. Band 27, S2, Dezember 2008, S. S31–S42, doi:10.1038/onc.2009.351.
- ↑ Massimo Levrero, Jessica Zucman-Rossi: Mechanisms of HBV-induced hepatocellular carcinoma. In: Journal of Hepatology. Band 64, 1 Suppl, April 2016, S. S84–S101, doi:10.1016/j.jhep.2016.02.021, PMID 27084040.
- ↑ Ci Song et al.: Associations Between Hepatitis B Virus Infection and Risk of All Cancer Types. In: JAMA network open. Band 2, Nr. 6, 5. Juni 2019, S. e195718, doi:10.1001/jamanetworkopen.2019.5718, PMID 31199446, PMC 6575146 (freier Volltext).
- ↑ Ingmar Wolffram: Neuer Check-up für die Leber: Warum Hepatitis-Tests so wichtig sind. Deutsches Ärzteblatt, 23. September 2022, abgerufen am 24. September 2022.
- ↑ Hartwig Klinker: Akute Hepatitis B. 2009, S. 297.
- ↑ RKI – Epidemiologisches Bulletin 34/2015 rki.de (PDF; 400 kB)
- ↑ World Health Organization: Programmes and Projects: Hepatitis B. (englisch).
- ↑ Mei-Hwei Chang et al.: Decreased incidence of hepatocellular carcinoma in hepatitis B vaccinees: a 20-year follow-up study. In: Journal of the National Cancer Institute. Band 101, Nr. 19, 7. Oktober 2009, S. 1348–1355, doi:10.1093/jnci/djp288, PMID 19759364.
- ↑ Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich. 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 322 f.
- ↑ H. Renz-Polster, S. Krautzig: Basislehrbuch Innere Medizin 4. Auflage, 2006, S. 649 ff.
- ↑ www.frauenaerzte-im-netz.de (Memento des vom 7. April 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- ↑ Epidemiologisches Bulletin 26/2020. In: RKI. 25. Juni 2020, abgerufen am 31. Dezember 2020.
- ↑ Hepatitis-B-Impfung: Genügt die Dauer des Impfschutzes, um eine Impfung im Säuglingsalter in Betracht zu ziehen? nach „Medecine et Enfance“ 2001 (Memento des vom 30. Dezember 2006 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- ↑ a b M. Cornberg, U. Protzer: Prophylaxe, Diagnostik und Therapie der Hepatitis-B-Virus-(HBV-)Infektion. In: Zeitschrift für Gastroenterologie. Band 45, Nr. 6, Juni 2007, S. 525–574, doi:10.1055/s-2007-963232, PMID 17554641 (PDF (Memento vom 1. Februar 2014 im Internet Archive) [abgerufen am 9. November 2016]). Prophylaxe, Diagnostik und Therapie der Hepatitis-B-Virus-(HBV-)Infektion (Memento des vom 1. Februar 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Miguel A. Hernán et al.: Recombinant hepatitis B vaccine and the risk of multiple sclerosis: a prospective study. In: Neurology. Band 63, Nr. 5, September 2004, S. 838–842, PMID 15365133.
- ↑ Hep B Vaccine and Multiple Sclerosis FAQs. In: CDC. 20. August 2020, abgerufen am 12. Mai 2021 (englisch).
- ↑ Gibt es einen Zusammenhang zwischen Hepatitis-B-Impfung und Multipler Sklerose? In: RKI. 22. Februar 2018, abgerufen am 12. Mai 2021.
- ↑ Mia Topsøe Mailand, Jette Lautrup Frederiksen: Vaccines and multiple sclerosis: a systematic review. In: Journal of Neurology. Band 264, Nr. 6, 1. Juni 2017, S. 1035–1050, doi:10.1007/s00415-016-8263-4.
- ↑ Julia Stowe et al.: Do Vaccines Trigger Neurological Diseases? Epidemiological Evaluation of Vaccination and Neurological Diseases Using Examples of Multiple Sclerosis, Guillain–Barré Syndrome and Narcolepsy. In: CNS Drugs. Band 34, Nr. 1, 1. Januar 2020, S. 1–8, doi:10.1007/s40263-019-00670-y, PMID 31576507, PMC 7224038 (freier Volltext).
- ↑ Susanne Gallus: Impfen verursacht keine Multiple Sklerose. In: Medical Tribune. 23. September 2019, abgerufen am 24. August 2021.
- ↑ Kann in der Schwangerschaft und Stillzeit geimpft werden? RKI, 26. März 2020, abgerufen am 23. August 2021.