Humane Noroviren
| Norwalk-Virus | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

Röntgenkristallstruktur des Norwalk-Virus-Kapsids | ||||||||||||||||||
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||
| ||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||
| Norwalk virus | ||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||
| NwV | ||||||||||||||||||
| Links | ||||||||||||||||||
|
Die Spezies Norwalk virus (abgekürzt NwV, auch NWV oder NV) mit dem Referenzstamm („exemplarischen Virus“) Humanes Norovirus (alias Norwalk-Virus) der humanpathogenen Noroviren umfasst unbehüllte, einzelsträngige RNA-Viren mit positiver Polarität aus der Familie Caliciviridae, Gattung Norovirus. Noro- ist ein künstlich gebildetes Präfix aus Norwalk, das 2004 offizielle taxonomische Bezeichnung wurde. Die hochkontagiösen (hochansteckenden) Noroviren verursachen beim Menschen neben zahlreichen weiteren Viren die viralen Gastroenteritiden (viraler Brechdurchfall, auch umgangssprachlich als Magen-Darm-Grippe bezeichnet). Sie sind neben den Rotaviren aus der Familie der Reoviridae für die Mehrzahl der nicht bakteriell verursachten Durchfallerkrankungen beim Menschen verantwortlich. Der Nachweis von humanen Noroviren ist in Deutschland nach § 7 Infektionsschutzgesetz namentlich meldepflichtig.
Erstbeschreibung[Bearbeiten | Quelltext bearbeiten]
Als erstes humanes Norovirus wurde das Norwalk-Virus in Stuhlproben eines viralen Gastroenteritis-Ausbruchs von 1968 in Norwalk, Ohio, durch Immunelektronenmikroskopie 1972 erstmals morphologisch charakterisiert.[3] Um den Zusammenhang zwischen dem gefundenen Virus und einer Gastroenteritis-Erkrankung beweisen zu können, wurde gereinigtes Stuhl-Ultrafiltrat (gewonnen aus menschlichem Kot erkrankter Patienten) an Freiwillige oral verabreicht, welche anschließend ebenfalls erkrankten. Dies ist die einzige mit Stand November 2018 vom International Committee on Taxonomy of Viruses (ICTV) bestätigte Spezies der Gattung Norovirus.[4]
Virologie[Bearbeiten | Quelltext bearbeiten]
Morphologie und Genom[Bearbeiten | Quelltext bearbeiten]
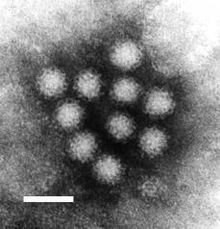
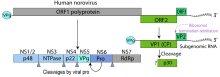
Noroviren haben einen Durchmesser von 35 bis 39 nm. Sie weisen im elektronenmikroskopischen Bild eine sehr unscharfe, runde Struktur auf. Sie besitzen ein ikosaedrisches (zwanzigflächiges) Kapsid (T=3-Symmetrie) und ein ca. 7,3 bis 7,7 kB großes Genom. Wie die meisten einzelsträngigen RNA-Viren sind Noroviren sehr variabel in ihrer Genomsequenz, weshalb zahlreiche verschiedene Subtypen und Isolate bekannt sind. Sie zeigen Antigendrift und auch eine saisonale Antigenshift durch genetische Rekombination zwischen unterschiedlichen Norovirusstämmen.[5]
Klassifikation[Bearbeiten | Quelltext bearbeiten]
Ursprünglich wurden drei humanpathogene Noroviren, nämlich das Norwalk-Virus, und das seltenere Humane Norovirus Alphatron (Alphatron-Virus) und das Humane Norovirus Saitama innerhalb der Gattung Norovirus unterschieden. Die ersten beiden werden vom ICTV der Spezies Norwalk virus der Gattung Norovirus zugeordnet,[6] das dritte bildet nach der NCBI-Taxonomie eine eigene vorgeschlagene Spezies „Human norovirus Saitama“.[7]
Die Spezies Norwalk virus – als einzige vom ICTV mit Stand 19. März 2024 bestätigte Spezies der Gattung – wird derzeit in 11 Subtypen (Stämme) unterteilt, wobei vier dieser Subtypen, basierend auf der Aminosäurensequenz des VP1-Kapsidproteins, wiederum zu sehr umfangreichen Genogruppen 1–4 (GGI bis GGIV) zusammengefasst werden können.[8][9] Derzeit ist vornehmlich Genotyp GII (im Speziellen GII.4) verantwortlich für Infektionen, gefolgt von GI und GIV.[10] Die Isolate und Subtypen werden nach einem internationalen Schema benannt und klassifiziert:[11]
- Spezies Norwalk virus[6]
- Humanpathogene Subtypen sind nach ICTV:
- Subtyp Norwalk-Virus (Hu/NV/NV/1968/US)
- Subtyp Lordsdale-Virus (Hu/NV/LD/GII/1993/UK)
- Subtyp Maryland-Virus (GII/1987/US)
- Subtyp Jena-Virus (GIII/1980/DE)
- Subtyp Alphatron-Virus (GIV/1988/NL)
- Subtyp Viseu-Virus (GVI/2007/PT)
- Subtyp Chiba-040502-Virus (GBIII/2004/JP)
- Subtyp Sapporo-HK299-Virus (GIC/2007/JP)
- Weitere humanpathogene Subtypen:
- Subtyp Desert-Shield-Virus (Hu/NV/DSV395/1990/SR) – NCBI: GI
- Subtyp Hawaii-Virus (Hawaii-Calicivirus) (Hu/NV/HV/1971/US) – NCBI
- Subtyp Mexiko-Virus (Hu/NV/MX/1989/MX) – NCBI: Norovirus Hu/TL24/1998/MEX
- Subtyp Snow-Mountain-Virus (Hu/NV/SMV/1976/US) – NCBI: GII
- Subtyp Southampton-Virus (Hu/NV/SHV/1991/UK) – NCBI: GI
- Humanpathogene Subtypen sind nach ICTV:
- Weitere Norovirus-Subtypen wurden in anderen Säugetieren entdeckt, wie in Schweinen, Rindern, Schafen, Katzen und Nagetieren. Die meisten molekularbiologischen Untersuchungen zu Norovirus werden an dem Murine Norovirus durchgeführt.[11]

- Nicht humanpathogene Subtypen sind nach ICTV:[6]
- Subtyp Murines Norovirus 1 (GV/US/2002)
- Subtyp Hunde-Norovirus (Canides Norovirus)
- Subtyp Fledermaus-Norovirus (GX/2010/CN)
- Nicht humanpathogene Subtypen sind nach ICTV:[6]
Epidemiologie[Bearbeiten | Quelltext bearbeiten]
Noroviren sind weltweit verbreitet. Jährlich kommt es zu ca. 685 Millionen Noroviruserkrankungen, welche 18 % der weltweiten akuten Gastroenteritisfälle ausmachen.[10]
Endemische Norovirusinfektionen wurden bislang v. a. in Krankenhäusern (gehäuft in geriatrischen Abteilungen) und Alten- oder Pflegeheimen nachgewiesen. In der Schweiz muss Schätzungen zufolge jährlich mit 400.000 bis 600.000 Infektionen durch diese Viren gerechnet werden. In Deutschland wurden für das Meldejahr 2013 89.322 labordiagnostisch bestätigte Fälle (Referenzdefinition seit 2011) an das Robert Koch-Institut übermittelt. 19 % davon wurden im Rahmen von Ausbrüchen registriert, davon etwa 2/3 in Krankenhäusern oder Alten- und Pflegeheimen, 1/7 in Kindergärten und Kindertagesstätten.[12] Bis in die 1990er Jahre war die Norovirus-Diagnostik wenigen Speziallaboratorien vorbehalten. Seit käufliche Immuntests zur Verfügung stehen, kann auch häufiger eine spezifische Infektion mit Noroviren nachgewiesen werden.
Im Herbst 2012 haben sich in Ostdeutschland fast elftausend Menschen durch aus China importierte Erdbeeren mit dem Norovirus infiziert. Der Norovirus-Ausbruch 2012 sorgte für große Medienaufmerksamkeit.[13]
Norovirusinfektionen treten in Mitteleuropa saisonal gehäuft in den Monaten November bis März auf, die Aktivität ist in den Sommermonaten nur etwa ein Zehntel so groß wie im Winter. Die durch eine Infektion erworbene Immunität gegen einen Virenstamm hält länger an als bis zur nächsten Saison, sodass der Erreger einem hohen Selektionsdruck durch Herdenimmunität ausgesetzt ist. Diesem weicht er durch Gendrift und -Shift aus.[14]
Epidemiologische Studien zeigten, dass Personen je nach den von ihnen gebildeten Histo-Blutgruppen Antigenen von spezifischen NoV Genotypen infiziert wurden. Genotyp GII.4, der die meisten Infektionen verursacht (zurzeit weitverbreitetster Genotyp, epidemie) bindet mehr verschiedene HBGA als jeder andere Genotyp. Menschen, die durch eine homozygotische Mutation eine nicht funktionale Fucosyltransferase besitzen, sogenannte Non-secretors, produzieren kein ABH-Antigen und sind deutlich weniger anfällig für eine Norovirus Infektion (haben jedoch keinen absoluten Schutz). Etwa 20 % aller Europiden sind Non-secretors.[15][16]
Zwischen März und August 2017 kam es in Quebec, Kanada, zu einem Ausbruch des Norovirus, an dem mehr als 700 Menschen erkrankten. Laut einer Untersuchung der kanadischen CFIA Food Control Agency wurde das Virus durch gefrorene Himbeeren eingetragen, die aus China importiert wurden.[17]
Übertragung[Bearbeiten | Quelltext bearbeiten]
Mit einer minimalen Infektionsdosis von nur 10 bis 100 Viruspartikeln ist die Kontagiosität der Noroviren außerordentlich hoch. Die Übertragung erfolgt von Mensch zu Mensch über eine Schmier- bzw. Tröpfcheninfektion. Die Viren werden über Stuhl oder Erbrochenes ausgeschieden und gelangen auf fäkal-oralem Weg, beim Einatmen des beim Erbrechen entstehenden Aerosols oder über kontaminierte Hände auf die Schleimhäute der Kontaktperson. Die Ansteckung mit Viren kann ebenfalls über kontaminierte Gegenstände erfolgen. Ferner ist eine Aufnahme der Erreger über kontaminiertes Wasser möglich, dies kann zum einen über Speisen und Getränke, welche mit kontaminiertem Wasser zubereitet wurden, aber auch durch das Trinken von verunreinigtem Leitungswasser erfolgen.[18] Humane Noroviren weisen die für unbehüllte Viren typische Resistenz gegenüber Umwelteinflüssen auf. Sie können im Wasser mehrere Tage bis Wochen bei 25 °C überstehen,[19] sie überstehen Temperaturschwankungen von −20 bis +60 °C und zeigten ihre „Überlebensfähigkeit“ auf einem kontaminierten Teppich noch nach zwölf Tagen.
In der Regel werden die Viren von erkrankten Personen während der akuten Erkrankung, aber auch nach Abklingen der klinischen Symptome ausgeschieden. Der Höhepunkt der Ausscheidung ist üblicherweise 4 Tage nach der Infektion, also meist nach dem Abklingen der Symptome. Auch symptomlose Infizierte können Virusausscheider sein. In einer Studie mit absichtlicher Infektion konnte das Virus im Median 4 Wochen nach Infektion im Stuhl nachgewiesen werden.[20] Daher ist die sorgfältige Beachtung üblicher Hygieneregeln auch im Anschluss an die Erkrankung von sehr großer Bedeutung.
Besonders gefährdet sind die Bewohner sowie das Personal von Gemeinschaftseinrichtungen aller Art, da durch Benutzung z. B. gemeinsamer Toiletten ein lokaler Ausbruch gefördert wird. In den letzten Jahren waren häufig auch Kreuzfahrtschiffe betroffen.[21]
Virale RNA von humanen Norovirus-Subtypen konnte in Stuhlproben aus Viehbeständen nachgewiesen werden, ebenso wurden Antikörper gegen tierische Norovirus-Subtypen in asymptomatischen Menschen gefunden. Dies bedeutet möglicherweise, dass Noroviren zoonotisch sind.[22][23]
Krankheitsverlauf und Symptome[Bearbeiten | Quelltext bearbeiten]
Akute Erkrankung[Bearbeiten | Quelltext bearbeiten]
Die Inkubationszeit der von den humanen Noroviren beim Menschen ausgelösten Erkrankung beträgt ca. 10–50 Stunden. Krankheitssymptome entwickeln sich innerhalb weniger Stunden bis Tage und bestehen in erster Linie aus einer Gastroenteritis mit plötzlich auftretendem Durchfall und Erbrechen, die zu erheblichen Flüssigkeitsverlusten (siehe Exsikkose) führen können. Daher sind besonders Kinder und ältere Menschen gefährdet. Meist besteht ein ausgeprägtes Krankheitsgefühl mit Bauchschmerzen, Übelkeit, Kopfschmerzen und Muskelschmerzen.
Die Erkrankung verläuft meist kurz und heftig und klingt nach ein bis drei Tagen wieder ab. Erbrechen kommt bei mehr als 50 % der Patienten vor, wobei Jugendliche mehr an Erbrechen, Erwachsene mehr an Durchfall leiden.
Chronische Erkrankung[Bearbeiten | Quelltext bearbeiten]
In Patienten mit einem geschwächten Immunsystem, z. B. durch das Variable Immundefektsyndrom oder Immunsuppression nach einer Transplantation, kann es zu einer chronischen Infektion mit Norovirus kommen.[24] Norovirus kann über mehrere Jahre hinweg im Stuhl nachgewiesen werden. Patienten können an lang andauerndem Durchfall leiden, die Infektion verläuft aber auch phasenweise asymptomatisch. In schweren Fällen kommt es zu Norovirus-assoziierter Enteropathie, was zu Zottenatrophie und Malassimilation führen kann.[24]
Folgen und Komplikationen[Bearbeiten | Quelltext bearbeiten]
Je nach Schwere der Erkrankung kann der Wasserverlust durch die Norovirusinfektion ohne Behandlung auch zum Tod führen. Noroviren sind verantwortlich für jährlich ca. 220.000 Todesfälle weltweit, zu größten Teilen in Ländern mit geringen und mittlerem Einkommen. Die Todesrate liegt hier bei 0,037 % verglichen mit einer Todesrate von 0,005 % in Ländern mit hohem Einkommen. Besonders betroffen sind mit 70 bis 80 % ältere Menschen ab 80 Jahren und Kinder unter 4 Jahren.[10] Seit 2001 besteht in Deutschland Meldepflicht für die Erkrankung. Nach Angaben des Robert Koch-Instituts (RKI) lag die Anzahl der Verstorbenen an den Noroviren in Deutschland wie folgt:[25] Die Darstellung von Grafiken ist aktuell auf Grund eines Sicherheitsproblems deaktiviert.
Nachweis[Bearbeiten | Quelltext bearbeiten]
Medizin[Bearbeiten | Quelltext bearbeiten]
Im Rahmen der medizinischen Diagnostik ist es möglich, jedoch nicht immer sinnvoll, Noroviren in Stuhlproben nachzuweisen. Die am häufigsten angewandte, jedoch auch teuerste Methode ist die RT-PCR (Nachweis über Reverse Transkription mit anschließender Polymerase-Kettenreaktion). Sie verfügt über eine hohe Sensitivität und Spezifität. Weitere verfügbare Nachweismethoden sind der ELISA (geringere Spezifität) und die Elektronenmikroskopie. Eine Virusisolierung in Zellkultur kann durch Zugabe von bestimmten Darmbakterien erreicht werden.[26]
Besondere Bedeutung kommt dem Erregernachweis im Rahmen von Ausbrüchen zu, da diese besondere hygienische Maßnahmen erforderlich machen. Allerdings wird nicht jede Erkrankung auf den Erreger hin untersucht, daher entsprechen die Meldezahlen nicht dem wahren Ausmaß der Erkrankung. Auch aufgrund einer fehlenden spezifischen Therapie wird die Notwendigkeit einer teuren Stuhldiagnostik von Fachleuten bezweifelt, wenn im Umfeld bereits Gastroenteritiden durch Noroviren nachgewiesen wurden. Eine Untersuchung auf Noroviren bei jedem einzelnen Patienten ist daher medizinisch unnötig und wenig wirtschaftlich, wenn Erkrankungsfälle in der Umgebung bekannt sind und die klassischen klinischen Symptome vorhanden sind.
Lebensmittel[Bearbeiten | Quelltext bearbeiten]
Problematisch für die Lebensmittelanalytik ist die Tatsache, dass Noroviren der Genogruppe I und II auf den Menschen wirtsspezifisch sind und bislang noch keine Zellkultur erhältlich ist, die eine Vermehrung ermöglicht.[27] Daher muss für die Untersuchung von Lebensmitteln stets eine Extraktion und Aufkonzentrierung erfolgen. Gemäß der amtlichen Methodensammlung § 64 LFGB L 00.00-147/2 (Übernahme der gleichlautenden Norm DIN CEN ISO/TS 15216-2) sind Wiederfindungsraten von 1 % bezogen auf weiche Lebensmittel mit rauer Oberfläche (wie Erdbeeren) bereits als akzeptabel zu bewerten. Die Infektiosität der Viruspartikel ist sehr hoch. Die analytische Nachweisgrenze ist in dem Hinblick in Lebensmitteln methodisch bedingt sehr schlecht. Aufgrund labortechnischer Limitierungen ist daher stets mit Unterbefunden zu rechnen, die zu einer nicht unerheblichen Dunkelziffer bei der Aufklärung von Norovirus-assoziierten Lebensmittelinfektionen führt.[28] Insbesondere TK-Früchte, die aus Regenmangelgebieten und hygienisch unterentwickelten Ländern eingeführt werden, sind daher stets mit einem nicht unerheblichen Risiko behaftet, das durch Analysen im Labor nicht vollständig ausgeschlossen werden kann.[29]
Behandlung[Bearbeiten | Quelltext bearbeiten]
Eine ursächliche antivirale Therapie ist nicht bekannt; die Behandlung ist rein symptomatisch und besteht lediglich im Ausgleich des Verlustes von Flüssigkeit und Elektrolyten (z. B. Natrium, Magnesium, Kalium, Kalzium, …). Bei starkem Erbrechen kann der Einsatz von übelkeitsmindernden Medikamenten (Antiemetika) erwogen werden. Insbesondere bei älteren Patienten oder Kleinkindern kann ein kurzer Krankenhausaufenthalt notwendig sein.
Vorbeugung[Bearbeiten | Quelltext bearbeiten]
Impfstoff-Forschung[Bearbeiten | Quelltext bearbeiten]
Eine vorbeugende Impfung ist bislang nicht verfügbar. Erste experimentelle Impfstoffe sind in Entwicklung.[30] Daher liegt der Schwerpunkt der Vorbeugung darauf, die Infektionskette zu unterbrechen.
Hygienische Maßnahmen[Bearbeiten | Quelltext bearbeiten]
Durch die Einhaltung von Hygienemaßnahmen sowie Einzel- oder Kohortenisolierung kann die Übertragung der Erreger begrenzt werden.[31] Dazu gehören vor allem die sorgfältige Händedesinfektion mit einem viruziden Händedesinfektionsmittel, dessen Wirkungsspektrum auch unbehüllte Viren mit einschließt, und gegebenenfalls die Verwendung von Atemschutzmasken mit hoher Schutzwirkung (Kategorie FFP-3), sowie die Desinfektion von kontaminierten Flächen bzw. Materialien.
Seifen und Handtücher sollten nicht von mehreren Personen gemeinsam benutzt werden, da die Noroviren gegen übliche Seifen und haushaltsübliche Desinfektionsmittel resistent sind. Häufiges Händewaschen reduziert jedoch durch die mechanische Entfernung von Viren eine Übertragung erheblich.
In medizinischen Einrichtungen wie Krankenhäusern müssen mit Noroviren kontaminierte Materialien als gefährliche Abfälle gekennzeichnet und entsorgt werden, um Neuinfektionen bei anderen Patienten und Personal zu vermeiden. Kittel, Handschuhe und Mund-Nasen-Schutz sind wegen der hohen Infektionsgefahr bereits nach einmaliger Verwendung dem infektiösen Abfall zuzuführen. Dieser wird unmittelbar am Ort des Anfallens, z. B. im Patientenzimmer, in verschlossenen Behältern gesammelt und ist vor dem Abtransport mit viruziden Mitteln äußerlich zu desinfizieren. Kontaminierte und auch mit Stuhl verunreinigte Wäsche (Leib-, Bettwäsche) muss als Infektionswäsche nach dem Doppelsack-Prinzip entsorgt werden.[32]
Desinfektionsmittel und Inaktivierungsverfahren[Bearbeiten | Quelltext bearbeiten]
Gegen Noroviren wirksame Händedesinfektionsmittel enthalten neben Ethanol – ab 80 Volumenprozent (Vol%) – ggf. noch weitere wirksame Bestandteile. Hier kommen z. B. Orthophosphorsäure, Zitronensäure, Milchsäure, Harnstoff etc. in Frage.[33][34][35][36] Untersuchungen haben gezeigt, dass die Effektivität von Alkohol durch die Zugabe von Harnstoff und Citronensäure erheblich gesteigert werden kann.[37] Insbesondere Citronensäure ist in der Lage, Oberflächenproteine des Norovirus so zu verändern, dass die Infektiosität hierdurch wahrscheinlich verringert wird.[38]
Nach Kingsley et al.[39] seien chlorhaltige Desinfektionsmittel zur Flächendesinfektion am wirksamsten. Bezüglich weiterer Substanzen wurde z. B. festgestellt, dass Peressigsäure innerhalb von 10 Minuten und Glutaraldehyd (1 %) innerhalb von 1 Minute bei Raumtemperatur auf mit Noroviren kontaminierten Arbeitsflächen und Oberflächen von Gemüse, Tomaten, Salat, Erdbeeren wirksam war.[40] Quaternäre Ammoniumverbindungen, die bakterizid sind, zeigten dagegen widersprüchliche Ergebnisse in der Noro-Virusinaktiverung. F. v. Rheinbaben berichtet über die virusinaktivierende Wirkung von angesäuerter Kaliumpermanganat-Lösung (pH 3, bei 0,1 % bis 0,5 % Kaliumpermanganat) innerhalb von 5 bis 60 Minuten.[41] Die virusinaktivierende Oxidationsreaktion ist abgeschlossen, wenn ein Farbumschlag von violett nach farblos erfolgt, allerdings werden dadurch auch Bakterien abgetötet.
Nach dem Norovirus-Ausbruch 2012 in Ostdeutschland, bei dem roh verzehrte Erdbeeren zu verstärkten Infektionen führten, wurde diskutiert, ob ein Durcherhitzen Noroviren sicher inaktivieren kann. Da Zellkultursysteme bisher nicht verfügbar sind, kann die verbliebene Infektiosität nach Erhitzung und den pH-Wert-Einflüssen nicht gemessen werden. Das Bundesinstitut für Risikobewertung (BfR) geht aufgrund der wissenschaftlichen Datenlage davon aus, dass ein nur kurzes Aufkochen bei der Herstellung von Kompottspeisen nicht ausreicht, um Noroviren in kontaminierten tiefgefrorenen Früchten sicher unschädlich zu machen.[42] Eine wesentliche Reduktion kann nur durch längeres Erhitzen (200 °C für 12 Minuten) oder Kochen (100 °C für 30 Minuten) erfolgen. Das Tiefgefrieren (−18 °C) von kontaminierten Lebensmitteln hat ebenso keinen wesentlichen Effekt.[43]
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Noroviren – Informationen des Robert Koch-Instituts
- S1-Leitlinie Hygienemaßnahmen bei Gastroenteritis-Ausbrüchen durch Noro-Viren der AWMF (Arbeitskreis „Krankenhaus- & Praxishygiene“). In: AWMF online (Stand 2013)
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e ICTV: ICTV Taxonomy history: Rabbit hemorrhagic disease virus, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- ↑ ICTV Master Species List 2018b v1. MSL #34, Feb. 2019
- ↑ R. Dolin, N. R. Blacklow u. a.: Biological properties of Norwalk agent of acute infectious nonbacterial gastroenteritis. In: Proceedings of the Society for Experimental Biology and Medicine, Band 140, Nummer 2, Juni 1972, S. 578–583. PMID 4624851.
- ↑ Master Species List 2018a v1. (Memento des vom 14. März 2019 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. ICTV, MSL including all taxa updates since the 2017 release. Fall 2018 (MSL #33)
- ↑ Noroviren. In: laborlexikon.de. 25. Januar 2011, abgerufen am 21. Januar 2015. ISSN 1860-966X
- ↑ a b c ICTV: Virus Metadata Resource (VMR).
- ↑ NCBI Taxonomy Bowser: Human norovirus Saitama (species).
- ↑ S. Ramirez, GM. Giammanco, S. De Grazia, C. Colomba, V. Martella, S. Arista: Genotyping of GII.4 and GIIb norovirus RT-PCR amplicons by RFLP analysis. In: J. Virol. Methods. 147. Jahrgang, Nr. 2, 2008, S. 250–6, doi:10.1016/j.jviromet.2007.09.005, PMID 17953996.
- ↑ A. Kroneman, E. Vega, H. Vennema et al.: Proposal for a unified norovirus nomenclature and genotyping. In: Archives of Virology. 158. Jahrgang, 10 pages=2059–2068, 2013, doi:10.1007/s00705-013-1708-5.
- ↑ a b c BA. Lopman, D. Steele, CD. Kirkwood, UD. Parashar: The Vast and Varied Global Burden of Norovirus: Prospects for Prevention and Control. In: PLOS Medicine. 13. Jahrgang, Nr. 4, 2016, doi:10.1371/journal.pmed.1001999.
- ↑ a b Claude M. Fauquet, M. A. Mayo (Hrsg.): Virus Taxonomy: Eighth Report of the International Committee on Taxonomy of Viruses. Academic Press, 2005, ISBN 0-08-057548-X, S. 847 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten. Robert Koch-Institut, 2013.
- ↑ Brechdurchfall in Ostdeutschland: China-Erdbeeren waren mit Noroviren verseucht. In: Spiegel Online. 8. Oktober 2012, abgerufen am 21. Januar 2015.
- ↑ B. Lopman, M. Zambon, D. W. Brown: The evolution of norovirus, the „gastric flu“. In: PLoS medicine. Band 5, Nummer 2, Februar 2008, S. e42, doi:10.1371/journal.pmed.0050042. PMID 18271623, PMC 2235896 (freier Volltext) (Review).
- ↑ L. Lindesmith, C. Moe, S. Marionneau u. a.: Human susceptibility and resistance to Norwalk virus infection. In: Nature Medicine. 9(5), Mai 2003, S. 548–553. Epub 2003 Apr 14. PMID 12692541.
- ↑ Reto Krapf: Häufige Krankheiten – modern behandelt: Norovirus-Infektion. In: nzz.ch. 27. März 2013, abgerufen am 21. Januar 2015.
- ↑ Dave Sherwood: How a Chilean raspberry scam dodged food safety controls from China to Canada. In: Reuters. Archiviert vom am 10. Oktober 2020; abgerufen am 10. Oktober 2020.
- ↑ Leena Maunula, Ilkka T. Miettinen, Carl-Henrik von Bonsdorff: Von Trinkwasser ausgehende Norovirus-Epidemien. In: Umwelt, Medizin, Gesellschaft. Band 19, 2006, S. 140–145; dugi-ev.de (Memento vom 27. Februar 2012 im Internet Archive; PDF). Übersetzung von L. Maunula, I. T. Miettinen, C.-H. von Bonsdorff: Norovirus Outbreaks from Drinking Water. In: Emerging Infectious Diseases. Band 11, Ausgabe 11, 2005, S. 1716–1721. PMID 16318723, PMC 3367355 (freier Volltext).
- ↑ J. Bae, K. J. Schwab: Evaluation of murine norovirus, feline calicivirus, poliovirus, and MS2 as surrogates for human norovirus in a model of viral persistence in surface water and groundwater. In: Applied Environmental Microbiology, Band 74, Ausgabe 2, 2008, S. 477–484. PMID 18065626, PMC 2223264 (freier Volltext).
- ↑ Robert L. Atmar, Antone R. Opekun, Mark A. Gilger u. a.: Norwalk Virus Shedding after Experimental Human Infection. In: Emerging Infectious Diseases. 14(10), Okt 2008, S. 1553–1557. PMID 18826818 (online)
- ↑ „Freedom of the Seas“: Virus wütet erneut auf größtem Kreuzfahrtschiff der Welt. In: Spiegel Online. 12. Dezember 2006, abgerufen am 21. Januar 2015.
- ↑ K. Mattison, A. Shukla u. a: Human noroviruses in swine and cattle. In: Emerging infectious diseases. 13. Jahrgang, Nr. 8, 2007, S. 1184–1188, doi:10.3201/eid1308.070005, PMID 17953089.
- ↑ Widdowson MA, Rockx B, Schepp R et al.: Detection of serum antibodies to bovine norovirus in veterinarians and the general population in the Netherlands. In: Journal of Medical Virology. 76. Jahrgang, 2005, S. 119–128, doi:10.1002/jmv.20333.
- ↑ a b K. Bok, K. Y. Green: Norovirus Gastroenteritis in Immunocompromised Patients. In: New England Journal of Medicine. 368. Jahrgang, Nr. 10, 16. März 2013, S. 971, doi:10.1056/NEJMc1301022, PMID 23465122, PMC 4793940 (freier Volltext).
- ↑ Infektionsepidemiologisches Jahrbuch. In: rki.de. 2011, abgerufen am 21. Januar 2015.
- ↑ M. K. Jones, M. Watanabe u. a.: Enteric bacteria promote human and mouse norovirus infection of B cells. In: Science, Band 346, Nummer 6210, November 2014, S. 755–759; doi:10.1126/science.1257147. PMID 25378626.
- ↑ B. Schütze: Lebensmittel assoziierte Risiken durch EHEC und Noroviren, Food Science Meets Industry 2013, Hamburg School of Food Science, Universität Hamburg 18. Februar 2013
- ↑ Noroviren in Lebensmitteln: Falsch-negative Analysenergebnisse bei Früchten möglich, LABO Online, 11. Februar 2014
- ↑ Noroviren auf Lebensmitteln. (Memento vom 19. März 2013 im Internet Archive; PDF) LADR informiert, ladr-lebensmittel.de, November 2012.
- ↑ Lars Fischer: Durchfall: Duell mit dem perfekten Virus. In: spektrum.de. 15. August 2012, abgerufen am 21. Januar 2015.
- ↑ Christina Berndt: Wie man sich Noroviren am besten vom Leib hält. In: Süddeutsche Zeitung. 21. Februar 2012, abgerufen am 27. Januar 2013.
- ↑ Mit Noroviren kontaminierten Abfall richtig entsorgen. Abfallmanager Medizin, 1. Oktober 2017, abgerufen am 9. August 2018.
- ↑ Friedrich von Rheinbaben: Handbuch viruswirksamer Desinfektionsmittel. 2002, S. 113ff.
- ↑ R. Nims, M. Plavsic: Inactivation of Caliciviruses. In: Pharmaceuticals (Basel), 2013 Mar, 6(3), S. 358–392. Review, doi:10.3390/ph6030358, PMC 3816691 (freier Volltext). Mit 123 Referenzen über chemisch-physikalische Inaktivierung von Caliciviren-Noroviren.
- ↑ Patent EP1685854B1: Viruzides Desinfektionsmittel. Angemeldet am 27. Januar 2006, veröffentlicht am 27. Oktober 2010, Anmelder: Braun Medical AG, Erfinder: Andreas Arndt, Olga Willi.
- ↑ Patent DE4424325C1: Alkoholische Desinfektionsmittel-Zubereitung. Angemeldet am 11. Juli 1994, veröffentlicht am 3. August 1995, Anmelder: MFH Marienfelde GmbH Unternehmen für Hygiene et al, Erfinder: Herbert Widulle et al (Phosphorsäure bis 3 % und Butanon in viruziden Desinfektionsmitteln).
- ↑ G. Ionidis et al.: Development and virucidal activity of a novel alcohol-based hand disinfectant supplemented with urea and citric acid. In: BMC Infectious Diseases 16, 2007, S. 77. doi:10.1186/s12879-016-1410-9, PMID 26864562.
- ↑ A. D. Koromyslova, P. A. White, G. S. Hansman: Treatment of norovirus particles with citrate. In: Virology. 485, Nov 2015, S. 199–204, doi:10.1016/j.virol.2015.07.009, PMID 26295280
- ↑ David H. Kingsley, Emily M. Vincent, Gloria K. Meadea, Clytrice L. Watsonb, Xuetong Fanc: Inactivation of human norovirus using chemical sanitizers. In: International Journal of Food Microbiology, Volume 171, 3. Februar 2014, S. 94–99, PMID 24334094.
- ↑ B. R. Gulati, P. B. Allwood et al.: Efficacy of commonly used disinfectants for the inactivation of calicivirus on strawberry, lettuce, and food-contact surface. In: J Food Prot. 64, 2001, S. 1430–1434, PMID 11563523.
- ↑ Handbuch Virus wirksamer Desinfektionsmittel. ISBN 978-3-642-63179-5, S. 69.
- ↑ Tenazität (Widerstandsfähigkeit) von Noroviren in Erdbeerkompott (PDF) Bundesinstitut für Risikobewertung, Stellungnahme Nr. 038/2012, 6. Oktober 2012.
- ↑ Nicola Siegmund-Schultze: Gastroenteritis-Ausbruch: Noroviren in Tiefkühlkost. In: Dtsch Arztebl. Band 109, Nr. 41, 2012 (aerzteblatt.de [abgerufen am 2. April 2017]).