Limonen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Vereinfachte Strukturformel mit markiertem Stereozentrum (*) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Limonen | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C10H16 | |||||||||||||||
| Kurzbeschreibung |
farblose, entzündbare Flüssigkeit mit zitrusartigem Geruch[3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 136,24 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,84 g·cm−3 ( | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
175 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
wenig in Wasser (14 mg·l−1 bei 25 °C)[3] | |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
D-Limonen: | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Limonen [] ist ein Naturstoff aus der Gruppe der Terpene (monocyclisches Monoterpen).
Struktur[Bearbeiten | Quelltext bearbeiten]
Limonen kommt in Form zweier Enantiomere vor, dem (R)-(+)-Limonen [auch als D-(+)-Limonen oder kurz (+)-Limonen bezeichnet] und dem (S)-(−)-Limonen [auch als L-(−)-Limonen oder kurz (−)-Limonen bezeichnet]. Das Racemat der beiden Enantiomere wird auch Dipenten genannt.
| Limonen | ||
| Name | (R)-Limonen | (S)-Limonen |
| Andere Namen | (+)-Limonen D-Limonen |
(−)-Limonen L-Limonen |
| Strukturformel | 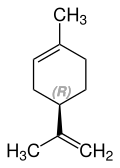
|

|
| CAS-Nummer | 5989-27-5 | 5989-54-8 |
| 138-86-3 (unspez.) | ||
| EG-Nummer | 227-813-5 | 227-815-6 |
| 205-341-0 (unspez.) | ||
| ECHA-Infocard | 100.025.284 | 100.025.286 |
| 100.004.856 (unspez.) | ||
| PubChem | 440917 | 439250 |
| 22311 (unspez.) | ||
| FL-Nummer | 01.045 | 01.046 |
| Wikidata | Q27888324 | Q27089405 |
| Q278809 (unspez.) | ||
Geschichte[Bearbeiten | Quelltext bearbeiten]
Limonen wurde erstmals 1878 von Gustave Bouchardat durch Erhitzen von Isopren hergestellt.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Limonen ist das in Pflanzen am häufigsten vorkommende Monoterpen. (R)-(+)-Limonen ist vor allem in Pomeranzenschalenöl, in Kümmelöl, in Dill,[8] in Grünem Kardamom,[9] in Sellerie,[9] in Korianderöl, in Krauseminzöl,[10] in Lorbeer,[9] in Muskatnuss,[9] in Petersilie,[9] in Teebaumöl,[9] in Zitronenöl (ca. 65 %)[11] und in Orangenöl (meist >90 %)[12] enthalten. Es weist einen orangenartigen Geruch auf. Dagegen ist (S)-(−)-Limonen in Minzölen[13] (wie Pfefferminze, Acker-Minze,[14] Speer-Minze,[14] Polei-Minze[14] und Wasserminze[14]) sowie in Baldrian (Valeriana officinalis),[14] Edeltannen- und Koniferenöl[13] und in Hanf (Cannabis sativa L.)[15] enthalten und riecht nach Terpentin. Das racemische Limonen kommt unter anderem im Kienöl, im sibirischen Bayöl,[16] Fichtennadelöl, Neroliöl, Muskatnussöl[17] und Campheröl, im Basilikum,[18] Wacholder[19] und in Waldkiefern[19] vor.
-
Zitronenöl enthält ca. 65 % (R)-(+)-Limonen.
-
Baldrian enthält (S)-(−)-Limonen.
Gewinnung/Darstellung[Bearbeiten | Quelltext bearbeiten]
Limonen wird in erster Linie durch Naturstoffextraktion gewonnen. (R)-(+)-Limonen fällt in großen Mengen als Nebenprodukt bei der Orangensaftproduktion an und wird durch Wasserdampfdestillation der dabei anfallenden Schalen gewonnen.[20] (S)-(−)-Limonen wird in verhältnismäßig kleinen Mengen aus den entsprechenden Ölen extrahiert. Das racemische Limonen fällt als Nebenprodukt bei der säurekatalysierten Isomerisierung von
Biosynthese[Bearbeiten | Quelltext bearbeiten]
Die Biosynthese von Limonen geht von Geranylpyrophosphat (GPP) aus.

Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Der spezifische Drehwinkel beträgt [
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Limonen ist licht-, luft-, wärme-, alkali- und säureempfindlich und autoxidiert zu Carvon.
Durch zwei aufeinander folgende Reaktionen mit Sauerstoff und Kohlendioxid entsteht Polylimonencarbonat, ein Stoff mit Polystyrol-ähnlichen Eigenschaften. Es ist Ausgangsstoff zur Synthese des
Sicherheitstechnische Kenngrößen[Bearbeiten | Quelltext bearbeiten]
Limonen bildet bei höherer Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 50 °C.[3][22] Der Explosionsbereich liegt zwischen 0,7 Vol.‑% (39 g/m3) als untere Explosionsgrenze (UEG) und 6,1 Vol.‑% (345 g/m3) als obere Explosionsgrenze (OEG).[3][22] Die Grenzspaltweite wurde mit 1,14 mm bestimmt.[3][22] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[3][22] Die Zündtemperatur beträgt 255 °C.[3][22] Der Stoff fällt somit in die Temperaturklasse T3.
Geruch[Bearbeiten | Quelltext bearbeiten]
Reines (R)-Limonen riecht höchstens schwach nach Orange. Der Orangengeruch von (R)-Limonen wird größtenteils von Verunreinigungen aus dem Ausgangsprodukt Orangenöl erzeugt. (S)-Limonen hingegen riecht nicht nach Zitrusfrüchten, sondern terpentinartig.[23]
Verwendung[Bearbeiten | Quelltext bearbeiten]

Traditionell wird Limonen als preiswerter Duftstoff eingesetzt.[24] Es ist als Aromastoff in Lebensmitteln zugelassen.[25]
Das gramnegative Bakterium Pseudomonas putida DSM 12264 vermag D-(+)-Limonen regioselektiv zur D-(+)-Perillasäure zu oxidieren, einem natürlichen Konservierungsmittel für Kosmetika.[26] Die biotechnologische Herstellung von D-(+)-Perillasäure aus D-(+)-Limonen im Labormaßstab wurde im Jahr 2010 verbessert. Der entwickelte Bioprozess stellt eine vielversprechende Option für eine industrielle Anwendung dar.[27]
Das D-(+)-Limonen wird als pflanzliches Insektizid verwendet.
Auch dient es als Ausgangsstoff für die Synthese von synthetischem THC (Dronabinol).[28] In neueren Prozessen dient Limonen auch als Ausgangsprodukt für Biokunststoffe.[29][30]
Heute wird es vorwiegend als biogenes Lösungsmittel verwendet und dient als Reiniger und Verdünnungsmittel, beispielsweise in der Lackindustrie.
Biologische Bedeutung[Bearbeiten | Quelltext bearbeiten]
Beim Metabolismus des Limonens entsteht hauptsächlich Perillinsäure, Dihydroperillinsäure, Limonen-1,2-diol und Uroterpenol. Limonen wirkt reizend. Seine Oxidationsprodukte D-(−)-Carvon und mehrere Isomere des Limonenoxid, die aus Limonen an der Luft entstehen, sind allergieauslösend.[31]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
D-(+)-Limonen wurde als für den Menschen nicht karzinogen eingestuft.[32]
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Eintrag zu Limonene in der Spectral Database for Organic Compounds (SDBS) des National Institute of Advanced Industrial Science and Technology (AIST)
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu LIMONENE in der CosIng-Datenbank der EU-Kommission, abgerufen am 23. Oktober 2021
- ↑ Eintrag zu 1-METHYL-4-METHYLVINYL-CYCLOHEXENE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c d e f g h i j k l m n o p Eintrag zu Dipenten in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. Februar 2017. (JavaScript erforderlich)
- ↑ a b c R. T. O’Connor, L. A. Goldblatt: Correlation of Ultraviolet and Infrared Spectra of Terpene Hydrocarbons, in: Analytical Chemistry. 26, 1954, S. 1726–1737; doi:10.1021/ac60095a014.
- ↑ Eintrag zu (±)-1-Methyl-4-(1-methylvinyl)cyclohexen im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 15. April 2023. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 5989-27-5 bzw. D-Limonen), abgerufen am 2. November 2015.
- ↑ Oyo Yakuri: Limonen. In: Pharmacometrics. Band 9, 1975, S. 387.
- ↑ Birgit Faber, Kerstin Bangert, Armin Mosandl: GC-IRMS and enantioselective analysis in biochemical studies in dill (Anethum graveolens L.). In: Flavour and Fragrance Journal. Band 12, Nr. 5, September 1997, S. 305–309, doi:10.1002/(SICI)1099-1026(199709/10)12:5<305::AID-FFJ659>3.0.CO;2-7.
- ↑ a b c d e f (+)-LIMONENE (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 28. August 2023.
- ↑ Valtcho D. Zheljazkov, Charles L. Cantrell, Tess Astatkie, M. Wayne Ebelhar: Productivity, Oil Content, and Composition of Two Spearmint Species in Mississippi. In: Agronomy Journal. Band 102, Nr. 1, Januar 2010, S. 129–133, doi:10.2134/agronj2009.0258.
- ↑ Eintrag zu Zitronenöl. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2014.
- ↑ Eintrag zu Limonen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2014.
- ↑ a b Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann's Encyclopedia of Industrial Chemistry. Band 15, 2012, S. 73–198, doi:10.1002/14356007.a11_141.
- ↑ a b c d e (-)-LIMONENE (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 28. August 2023.
- ↑ Nils Günnewich, Jonathan E. Page, Tobias G. Köllner, Jörg Degenhardt, Toni M. Kutchan: Functional Expression and Characterization of Trichome-Specific (-)-Limonene Synthase and (+)-
α -Pinene Synthase from Cannabis sativa. In: Natural Product Communications. Band 2, Nr. 3, März 2007, S. 1934578X0700200, doi:10.1177/1934578X0700200301. - ↑ J. Abaul, P. Bourgeois, J. M. Bessiere: Chemical composition of the essential oils of chemotypes ofPimenta racemosa var.racemosa (P. Miller) J. W. Moore (Bois d'Inde) of Guadeloupe (F.W.I.). In: Flavour and Fragrance Journal. Band 10, Nr. 5, September 1995, S. 319–321, doi:10.1002/ffj.2730100506.
- ↑ DL-LIMONENE (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 28. August 2023.
- ↑ Ocimum basilicum (Lamiaceae) (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 28. Juni 2021.
- ↑ a b R. Hiltunen, I. Laakso: Gas chromatographic analysis and biogenetic relationships of monoterpene enantiomers in Scots Pine and juniper needle oils. In: Flavour and Fragrance Journal. Band 10, Nr. 3, Mai 1995, S. 203, doi:10.1002/ffj.2730100314.
- ↑ Rosaria Ciriminna, Monica Lomeli-Rodriguez, Piera Demma Carà, Jose A. Lopez-Sanchez und Mario Pagliaro: Limonene: a versatile chemical of the bioeconomy, Chem. Comm., 2014, 50, S. 15288–15296, doi:10.1039/c4cc06147k.
- ↑ Horst Surburg, Johannes Panten (Hrsg.): Common Fragrance and Flavor Materials: Preparation, Properties and Uses. 6. Auflage. Wiley-VCH, 2016, S. 54, doi:10.1002/9783527693153.
- ↑ a b c d e E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ Klaus Roth et al.: Limonen: auf der Suche nach dem verborgenen Duft. In: Chemie in unserer Zeit. Band 57, Nr. 5. Wiley-Vch, Weinheim 2023, doi:10.1002/ciuz.202200038.
- ↑ Juliane Daphi-Weber, Heike Raddatz, Rainer Müller: Untersuchung von Riechstoffen – Kontrollierte Düfte, S. 94–95, in Band V der Reihe HighChem hautnah – Aktuelles aus der Lebensmittelchemie (Herausgegeben von der Gesellschaft Deutscher Chemiker) 2010, ISBN 978-3-936028-64-5.
- ↑ Eintrag zu Limonene in der Food and Feed Information Portal Database, abgerufen am 25. September 2023.
- ↑
Ruben Eckermann: Mit Bakterien gegen Bakterien. In: Nachrichten aus der Chemie. Band 59, 2011, S. 619–620.
Für die biotechnologische Herstellung von Perillasäure verlieh die Arbeitsgemeinschaft industrieller Forschungsvereinigungen „Otto von Guericke“ (AiF) den Otto von Guericke-Preis 2011 an Jens Schrader vom Karl-Winnacker-Institut (heute DECHEMA-Forschungsinstitut). - ↑ M. A. Mirata et al.: Integrierte Bioproduktion und selektive Aufreinigung von Perillasäure, Chemie Ingenieur Technik. 82, 2010, S. 101–109.
- ↑ ApSimon: "The Total Synthesis of Natural Products" Vol. 4 John Wiley & Sons, New York Chichester Brisbane Toronto, S. 233.
- ↑ Bähr, M.; Bitto, A.; Mühlhaupt, R.: Cyclic limonene dicarbonate as a new monomer for non-isocyanate oligo- and polyurethanes (NIPU) based upon terpenes. In: Green Chemistry 14 (1012), S. 1447–1454, doi:10.1039/C2GC35099H.
- ↑ Firdaus, M.; Meier, M.A.R.: Renewable polyamides and polyurethanes derived from limonene. In: Green Chemistry 15 (1013), S. 370–380, doi:10.1039/C2GC36557J.
- ↑ A.T. Karlberg et al. (1992): Air oxidation of d-limonene (the citrus solvent) creates potent allergens. In: Contact Dermatitis. Bd. 26, S. 332–340, PMID 1395597.
- ↑ Eintrag zu Limonen in der Hazardous Substances Data Bank (via PubChem), abgerufen am 3. März 2010.




