Natrium oksalat
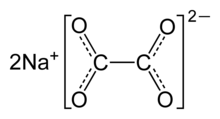
Natrium oksalat, atau dinatrium oksalat, adalah garam natrium asam oksalat dengan rumus kimia Na2C2O4. Senyawa ini adalah padatan putih, kristal, tidak berbau, yang terurai di atas 290 °C.[2]
| |
| Nama | |
|---|---|
| Nama IUPAC
Natrium etandioat
| |
| Nama lain
Garam dinatrium asam oksalat
Natrium etandioat | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| Na2C2O4 | |
| Massa molar | 133.999 g mol−1 |
| Densitas | 2.34 g cm−3 |
| Titik lebur | 260 °C (500 °F; 533 K) terurai di atas 290 °C[2] |
| 2.69 g/100 mL (0 °C) 3.7 g/100 mL (20 °C) 6.25 g/100 mL (100 °C) | |
| Kelarutan | dilarutkan dalam asam format tidak larut dalam alkohol, eter |
| Struktur | |
| monoclinic | |
| Termokimia | |
| Entalpi pembentukan standar ( |
-1318 kJ/mol |
| Bahaya | |
| Lembar data keselamatan | Oxford MSDS |
Klasifikasi UE (DSD) (usang)
|
|
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
11160 mg/kg (oral, mencit)[1] |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Dinatrium oksalat dapat bertindak sebagai zat pereduksi, dan dapat digunakan sebagai standar primer untuk menstandardisasi larutan kalium permanganat (KMnO4).
Bentuk mineral natrium oksalat adalah natroksalat. Mineral ini sangat jarang ditemukan dan terbatas pada kondisi pegmatit ultra-alkali.[3]
Preparasi
suntingNatrium oksalat dapat dibuat melalui netralisasi asam oksalat dengan natrium hidroksida (NaOH) dalam perbandingan molar asam-dengan-basa 1: 2. Penguapan senyawa ini menghasilkan oksalat anhidrat[4] yang dapat dikeringkan secara menyeluruh dengan memanaskan antara 200 dan 250 °C.[2]
Setengah netralisasi dapat dicapai dengan NaOH dalam rasio 1:1 yang menghasilkan NaHC2O4, natrium oksalat monobasa atau natrium hidrogenoksalat.
Reaksi
suntingNatrium oksalat mulai terurai di atas 290 °C menjadi natrium karbonat dan karbon monoksida:[2]
- Na2C2O4 → Na2CO3 + CO
Saat dipanaskan di antara 200 dan 525 °C dengan vanadium pentoksida dalam perbandingan molar 1:2, reaksi di atas ditekan, menghasilkan natrium vanadium oksiperunggu dengan melepaskan karbon dioksida[5]
- x Na2C2O4 + 2 V2O5 → 2 NaxV2O5 + 2x CO2
dengan x meningkat hingga 1 saat suhu meningkat.
Natrium oksalat digunakan untuk menstandardisasi larutan kalium permanganat. Suhu campuran titrasi sebaiknya dibuat lebih besar dari 60 °C untuk memastikan bahwa semua permanganat yang ditambahkan bereaksi dengan cepat. Kinetika reaksi ini kompleks, dan ion mangan(II) terbentuk mengkatalisasi reaksi lebih lanjut antara permanganat dan asam oksalat (membentuk in situ dengan penambahan asam sulfat berlebih). Persamaan akhirnya adalah sebagai berikut:[6]
- 5 Na2C2O4 + 2 KMnO4 + 8 H2SO4 → K2SO4 + 5 Na2SO4 + 2 MnSO4 + 10 CO2 + 8 H2O
Lihat pula
suntingReferensi
sunting- ^ a b "ChemIDplus - 62-76-0 - ZNCPFRVNHGOPAG-UHFFFAOYSA-L - Disodium oxalate - Similar structures search, synonyms, formulas, resource links, and other chemical information". chem.nlm.nih.gov (dalam bahasa Inggris). NIH. Diakses tanggal 7 January 2019.
- ^ a b c d Yoshimori T1, Asano Y, Toriumi Y, Shiota T. (1978) "Investigation on the drying and decomposition of sodium oxalate". Talanta, volume 25, issue 10, hlm. 603-605. DOI:10.1016/0039-9140(78)80158-1
- ^ "Natroxolate" (PDF). RRUFF. Mineral Data Publishing. Diakses tanggal 7 Januari 2019.
- ^ H. W. Foote and John E. Vance (1933), "The system; sodium iodate, sodium oxalate, water". American Journal of Science, series 5, volume 26, issue 151, pages 16-18. DOI:10.2475/ajs.s5-26.151.16
- ^ D. Ballivet-Tkatchenko, J. Galy, -M. Savariault (1994): "Thermal decomposition of sodium oxalate in the presence of V2O5: Mechanistic approach of sodium oxibronzes formation". Thermochimica Acta, volume 232, issue 2, hlm. 215-223. DOI:10.1016/0040-6031(94)80061-8
- ^ Mcbride, R. S. (1912). "The standardization of potassium permanganate solution by sodium oxalate". J. Am. Chem. Soc. 34 (4): 393–416. doi:10.1021/ja02205a009.