Fosfonat
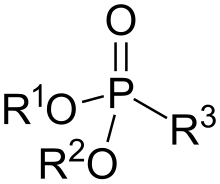
Fosfonati i fosfonske kiseline su organofosforni spojevi koji sadrže grupu C-PO (OH)2 ili C-PO(OR)2 (gdje je R = alkil, aril). Fosfonske kiseline, s kojima se obično radi kao solima, uglavnom su nehlapljive čvrste supstance koje su slabo rastvorljive u organskim rastvaračima, ali su topive u vodi i uobičajenim alkoholima. Mnogi komercijalno važni spojevi su fosfonati, uključujući glifosat (aktivna molekula herbicida "Roundup") i etefon, široko korišteni regulator rasta biljaka. Bisfosfonati su popularni lijekovi za liječenje osteoporoza.[1]
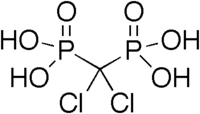
U biologiji i medicinskoj hemiji, fosfonatne grupe koriste se kao stabilne bioizoteri za fosfate, kao u antivirusnom analogu nukleotida, Tenofoviru, jednom temeljnom anti-HIV lijeku.
Osnovna svojstva
[uredi | uredi izvor]Fosfonati imaju tetraedarske fosforne centre. Strukturno su blisko povezani (i često su pripremljeni od) fosforne kiseline.[2]

Fosfonatne soli rezultat su deprotoniranja fosfonskih kiselina, koje su diprotne kiseline:
- RPO(OH)2 + NaOH → H2O + RPO(OH)(ONa) (mononatrij-fosfonat)
- RPO(OH)(ONa) + NaOH → H2O + RPO(ONa)2 (dinatrij fosfonat)
Estri fosfonata rezultat su kondenzacije fosfonskih kiselina sa alkoholima.
Sinteza
[uredi | uredi izvor]Postoji nekoliko metoda za pripremu fosfonskih kiselina i njihovih soli.
Iz fosfonske kiseline
[uredi | uredi izvor]Većina procesa započinje sa fosfornom kiselinom (poznata kao fosfonska kiselina, H3PO3), iskorištavajući njegovu reaktivnu P-H vezu.[1][2]
Fosfonska kiselina može se alkilirati Mannichovom reakcijom dajući aminometilirane fosfonate, koji su korisni kao kompleksi. Jedan od primjera je industrijski pripravak nitrilotris (metilenfosfonska kiselina):
- NH3 + 3 H3PO3 + 3 CH2O → N(CH2PO3H2)3 + 3 H2O
Fosfonska kiselina također može biti alkilirna derivatima akrilne kiseline da bi se dobili fosfonske kiseline funkcionalizirane karboksilnom kiselinom. Ova reakcija je varijanta Michaelove adicije:CH2=CHCO2R + 3 H3PO3 → (HO)2P(O)CH2CH2CO2R
U Hirao sprezanju dialkil fosfiti (koji se također mogu promatrati kao diestri fosfonske kiseline: (O = PH (OR)2) prolaze kroz katalizu paladijeve reakcije spajanja sa aril-halogenidom da bi se dobio fosfonat.
Michaelis-Arbuzova reakcija
[uredi | uredi izvor]Fosfonski estri pripremaju se pomoću Michaelis – Arbuzovljeve reakcije. Naprimjer, metil jodid katalizuje konverziju trimetilfosfita u ester fosfonata dimetil-metilfosfonat:
- P(OMe)3 → MePO(OMe)2
Ovi estri mogu se hidrolizirati u kiselinu (Me = metil):
- MePO(OMe)2 + H2O → MePO(OH)2 + 2 MeOH
U Michaelis–Beckerovoj reakciji, diester hidrogen fosfonata se prvo deprotonira, a rezultirajući anion alkilira.
Iz fosfornog trihlorida
[uredi | uredi izvor]Vinilfosfonska kiselina može se dobiti reakcijom PCl3 and acetaldehyde:
- PCl3 + CH3CHO → CH3CH(O−)PCl+
3
Ovaj adukt reagira sa acetatnom kiselinom:
- CH3CH(O−)PCl+
3 + 2 CH3CO2H → CH3CH(Cl)PO(OH)2 + 2 CH3COCl
Ovaj hlorid prolazi kroz dehidrokloriranje da bi se dobio cilj:
- CH3CH(Cl)PO(OH)2 → CH2=CHPO(OH)2 + HCl
U Kinnear–Perrenovoj reakciji alkilfosfonil dihloridi iestri generiraju su putem alkilacije fosfor-trihlorida u prisustvu aluminij-trihlorida. Međuprodukti su alkiltrihlorofosfonijske soli:[1]
- PCl3 + RCl + AlCl3 → RPCl+
3 + AlCl−
4
RPCl+
3 proizvod zatim se može razgraditi vodom da bi se dobio alkilfosfonski dihlorid RP (=O)Cl 2.
Reakcije
[uredi | uredi izvor]Hidroliza
[uredi | uredi izvor]Fosfonatni estri su općenito podložni hidrolizi i pod kiselim i pod baznim uslovima. Cijepanje P-C veze je teže, ali se može postići pod agresivnim uvjetima:
- O=PC(OR)2 + 2 H2O → O=PC(OH)2 + 2 ROH
Horner–Wadsworth–Emmonsova reakcija
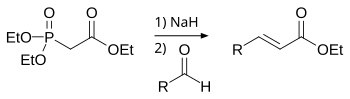
[uredi | uredi izvor]U Horner–Wadsworth–Emmonsovoj reakciji, dialkil- fosfonati su deprotonirani, dajući stabilizirane karbanione, koji reaguju sa aldehidima dajući E-alkene uklanjanjem dialkil-fosfata.[3]
Strukturbe potklase
[uredi | uredi izvor]Bisfosfonati
[uredi | uredi izvor]
Spojevi koji sadrže dvije geminalne fosfonatne grupe poznati su kao bisfosfonati. Prvi su ih sintetizirali Von Baeyer i Fritz Hofmann Hofmann 1897. a sada čine osnovu za važnu klasu lijekova koji se koriste za liječenje osteoporoze i sličnih bolesti. Primjeri uključuju HEDP (etidronska kiselina ili Didronel), koja se priprema od fosforne kiseline i acetatnog anhidrida:[1]
- 2 H3PO3 + (CH3CO)2O → CH3C(OH)(PO3H2)2 + CH3CO2H
Tiofosfonati
[uredi | uredi izvor]Grupa tiofosfonataje funkcionalna grupa povezana sa fosfonatom supstitucijom sumpora u atomu kisika. Oni su reaktivna komponenta mnogih pesticida i nervnih sredstava. Supstituirani tiofosfonati mogu imati dva glavna strukturne izomerne veze, bilo O ili S grupe, dajući tionske i tiolne oblike. Ovo je svojstvo koje dijele sa srodnim funkcionalnim skupinama kao što su tiokarboksilna kiselina i organotiofosfat.
Fosfonamidati
[uredi | uredi izvor]Fosfonamidati su povezani sa fosfonatima, supstitucijom dušikovog atoma kisika. Oni su rijetka funkcionalna grupa, a primjer je nervni agens tabun.
Pojava u prirodi
[uredi | uredi izvor]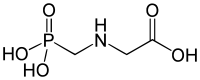

Fosfonati su jedan od tri izvora unosa fosfata u biološke ćelije. Druga dva su anorganski fosfati i organofosfati.
Prirodna fosfonatna 2-aminoetilfosfonska kiselina prvi je put identificirana 1959. godine u biljkama i mnogim životinjama, gdje je lokalizirana u membranama. Fosfonati su prilično česti među različitim organizmima, od prokariota do eubakterija i gljiva, mekkušaca, insekata i drugih. O njima su prvi put izvijestili (u prirodnim tlima) Newman i Tate (1980). Biološka uloga prirodnih fosfonata još uvijek je slabo razumljiva. Nije utvrđeno da li se prirodno javljaju bis- ili polifosfonati.
Identificiran je niz supstanci fosfonata prirodnog proizvoda sa antibiotskim svojstvima.[4] Antibiotici fosfonatnih prirodnih proizvoda uključuju fosfomicin koji je odobrila FDA za liječenje nekompliciranih infekcija urinarnog trakta, kao i nekoliko prethodno klinički istraženih supstanci poput Fosmidomicina (inhibitor izoprenil sintaze), SF-2312 (inhibitor glikolitičkog enzima enolaza,[5] i supstance nepoznatog načina djelovanja kao što je alahopcin. Iako su fosfonati duboko nepropusni za ćelije, njihovi antibiotici prirodnog proizvoda djelotvorni su protiv brojnih organizama, jer mnoge bakterijske vrste imaju unosnike glicerol-3-fosfata i glukoza-6-fosfata, koje fosfonatni antibiotici mogu oteti. Sojevi bakterija otporni na fosfomicin često imaju mutacije koje inaktiviraju ove prenosnike; međutim, takve mutacije se ne održavaju u odsustvu antibiotika zbog troškova proizvodnje.
Upotreba
[uredi | uredi izvor]U 1998. godini potrošnja fosfonata bila je 56.000 tona širom svijeta – 40.000 tona u SAD-u, 15.000 tona u Evropi i manje od 800 tona u Japanu. Potražnja za fosfonatima kontinuirano raste po stopi od 3% godišnje.
Metalni helati
[uredi | uredi izvor]Od rada Gerolda Schwarzenbacha, 1949., fosfonske kiseline su poznate kao efikasni helatni agensi. Uvođenje aminske grupe u molekulu da bi se dobio -NH2-C-PO (OH)2 povećavajući sposobnost vezanja metalnih fosfonata. Primjeri takvih spojeva su NTMP, EDTMP i DTPMP. Ovi fosfonati su strukturni analozi dobro poznatih aminopolikarboksilata, kao što je EDTA. Stabilnost metalnih kompleksa raste s povećanjem broja grupa fosfonske kiseline. Fosfonati su vrlo topljivi u vodi, dok su fosfonske kiseline vrlo rijetko takve.
Fosfonati su učinkovita helatna sredstva. Odnosno, čvrsto se vežu za dvo- i trovalentne ione metala, što je korisno za omekšavanje vode. Na taj način sprečavaju stvaranje netopljivih taloga (kamenaca). Vezanjem ovih liganada, potiskuju se i katalitska svojstva metalnih iona. Stabilni su u teškim uvjetima. Iz tih razloga važna industrijska upotreba fosfonata je u rashladnim vodama, sistemima za desalinizaciju i na naftnim poljima, da bi se inhibiralo stvaranje kamenca. Fosfonati se također redovno koriste u sistemima reverzne osmoze, kao antiscalanti. Fosfonati u sistemima za hlađenje vode također služe za kontrolu korozije gvožđa i čelika. U proizvodnji celuloze i papira i u tekstilnoj industriji služe kao "stabilizatori izbjeljivačkog peroksida", heliranjem metala koji bi mogli deaktivirati peroksid. U deterdžentima se koriste kao kombinacija helatnog sredstva, inhibitora kamenca i stabilizatora izbjeljivača. Fosfonati se takođe sve više koriste u medicini, za liječenje poremećaja povezanih s formiranjem kostiju i metabolizmom kalcija. Nadalje, oni služe kao nosači radionuklida u tretmanima karcinoma kostiju (vidi samarij-153-etilen diamin-tetrametilen fosfonat).
Dodaci betonu
[uredi | uredi izvor]Fosfonati se koriste i kao usporivači stvrdnjavanja betona.[6][7] Oni odgađaju vrijeme vezivanja cementa, omogućavajući duže vrijeme za postavljanje betona ili širenje toplinske hidratacije cementa na duži vremenski period, kako bi se izbjegle previsoke temperature i nastale pukotine. Oni takođe imaju povoljna svojstva raspršivanja, pa su istraženi kao moguća nova klasa superplastifikatora. Međutim, sada fosfonati nisu komercijalno dostupni kao superplastifikatori. Superplastifikatori su dodaci betonu dizajnirani da povećaju fluidnost i obradivost betona ili da smanje njegov odnos vode i cementa (w/c). Smanjivanjem sadržaja vode u betonu smanjuje njegovu poroznost, poboljšavajući tako mehanička svojstva (pritisak i vlačna čvrstoća) i trajnost betona (niža transportna svojstva vode, plina i rastvorenih tvari).[8]
Medicina
[uredi | uredi izvor]U medicini se fosfonati i bisfosfonati obično koriste kao inhibitori enzima koji fosfate i difosfate koriste kao supstrat. Najvažnije je da ovi enzimi uključuju one koji proizvode međuprodukte biosinteze holesterola .[9]
Fosfonatni nukleotidni analozi, kao što su Tenofovir, Cidofovir i Adefovir su kritični antivirusni lijekovi koji se u različitim oblicima predlijekova koriste za liječenje HIV<, hepatitisa B i drugih bolesti.
Niša korištenja
[uredi | uredi izvor]Zajedno s organosilikatima, fosfonati koriste se i za liječenje "iznenadne hrastove smrti", koju uzrokuje gljivasti eukariot Phytophthora ramorum.
Toksikologija
[uredi | uredi izvor]Toksičnost fosfonata za organizme koji žive u vodi je mala. Prijavljene vrijednosti za 48-satne LC 50 vrijednosti (letalnost 50%) za ribe su između 0,1 i 1,1 mM. Također je faktor biokoncentracije za ribe vrlo nizak.
Biorazgradnja
[uredi | uredi izvor]U razgradnji fosfonata, glavnu ulogu u prirodi imaju bakterije.[10] Zbog prisustva prirodnih fosfonata u okolini, bakterije su razvile sposobnost metabolizma fosfonata kao hranjivih izvora. Neke bakterije koriste fosfonate kao izvor fosfora za rast. Aminofosfonate neke također mogu koristiti kao jedini izvor dušika. Polifosfonati koji se koriste u industriji uveliko se razlikuju od prirodnih fosfonata kao što je 2-aminoetilfosfonska kiselina, jer su mnogo veći, nose visok negativni naboj i složeni su s metalima. Ispitivanja biorazgradnje sa muljem iz komunalnih postrojenja za prečišćavanje otpadnih voda sa HEDP i NTMP nisu pokazala indikacije bilo kakve razgradnje. Istraživanje HEDP-a, NTMP-a, EDTMP-a i DTPMP-a u standardnim testovima biorazgradnje također nije uspjelo identificirati bilo kakvu biorazgradnju. Primijećeno je, međutim, da je u nekim ispitivanjima, zbog visokog odnosa mulja i fosfonata, došlo do uklanjanja ispitivane supstance iz otopine, uočeno kao gubitak DOC-a. Ovaj faktor se pripisuje adsorpciji, a ne biorazgradnji. Međutim, sojevi bakterija sposobni za razgradnju aminopolifosfonata i HEDP-a u uvjetima ograničenim P izolirani su iz tla, jezera, otpadnih voda, aktivnog mulja i komposta.
"Ne primjećuje se nikakva biorazgradnja fosfonata tokom obrade vode, ali fotodegradacija kompleksa Fe (III) je brza. Aminopolifosfonati se takođe brzo oksidiraju u prisustvu Mn (II) i stvaraju se kisik i stabilni produkti raspadanja, otkriveni u otpadnim vodama. Nedostatak informacija o fosfonatima u okolini povezan je s analitičkim problemima njihovog određivanja pri koncentracijama u tragovima u prirodnim vodama. Fosfonati su uglavnom prisutni kao kompleksi Ca i Mg u prirodnim vodama i stoga ne utiču na specifikaciju metala ili transport."[11]
Fosfonati snažno komuniciraju s nekim površinama, što rezultira značajnim uklanjanjem u tehničkim i prirodnim sistemima.
Spojevi fosfonata
[uredi | uredi izvor]- Tenofovir alafenamid: Predlijek nukleotidnog analoga Tenofovir, kritičan za liječenje HIV-a;
- AMPA: Aminometilfosfonska kiselina, proizvod razgradnje glifosata;
- Vinilfosfonska kiselina: monomer;
- Dimetil-metilfosfonat (DMMP), jedan od najjednostavnijih diestera fosfonata;
- Etidronska kiselina (HEDP): 1-hidroksietiliden-1,1-difosfonska kiselina, koristi se u deterdžentima, tretmanu vode, kozmetici i farmaceutskim proizvodima;
- ATMP: Aminotris (metilenfosfonska kiselina), helatno sredstvo;
- EDTMP: Etilendiaminetetra (metilenfosfonska kiselina), helatno sredstvo;
- TDTMP: Tetrametilendiaminetetra (metilenfosfonska kiselina), helatno sredstvo;
- HDTMP: Heksametilendiaminetetra (metilenfosfonska kiselina), helatno sredstvo;
- DTPMP: dietilenetriaminepenta (metilenfosfonska kiselina), helatno sredstvo;
- PBTC: fosfonobutanetrikarboksilna kiselina;
- PMIDA: N- (fosfonometil) iminodiacetna kiselina;
- CEPA: 2-karboksietil fosfonska kiselina;
- HPAA: 2-hidroksifosfonokarbonska kiselina;
- AMP: Aminotris (metilenfosfonska kiselina);
- BPMG: N,N- bis (fosfonometil) glicin;
- Glifosat: uobičajeni poljoprivredni herbicid
- Foscarnet: za liječenje herpesa;
- Perzinfotel: za liječenje moždanog udara;
- SF2312: prirodni proizvod inhibitor fosfonatnog antibiotika enolaza;
- Selfotel: napušteni eksperimentalni lijek za moždani udar.
Također pogledajte
[uredi | uredi izvor]- Organofosforni spojwevi
- Fosfin-oksid - OPR3
- Fosfinit -P(ILI)R2
- Fosfonit -P (ILI)2R
- Fosfit - P (ILI) 3
- Fosfinat -OP (ILI) R 2
- Fosfat -OP (ILI)3
Reference
[uredi | uredi izvor]- ^ a b c d Svara, J.; Weferling, N.; Hofmann, T. "Phosphorus Compounds, Organic," in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2008. doi:10.1002/14356007.a19_545.pub2.
- ^ a b Modern Phosphonate Chemistry by Philippe Savignac and Bogdan Iorga, CRC Press, Boca Raton, FL, 2003. ISBN 0-8493-1099-7
- ^ Boutagy, John; Thomas, Richard (februar 1974). "Olefin synthesis with organic phosphonate carbanions". Chemical Reviews. 74 (1): 87–99. doi:10.1021/cr60287a005.
- ^ Ju KS, Doroghazi JR, Metcalf WW (2014). "Genomics-enabled discovery of phosphonate natural products and their biosynthetic pathways". J. Ind. Microbiol. Biotechnol. 41 (2): 345–356. doi:10.1007/s10295-013-1375-2. PMC 3946943. PMID 24271089.
- ^ Leonard PG, Satani N, Maxwell D, Lin YH, Hammoudi N, Peng Z, Pisaneschi F, Link TM, Lee GR, Sun D, Prasad BA, Di Francesco ME, Czako B, Asara JM, Wang YA, Bornmann W, DePinho RA, Muller FL (decembar 2016). "SF2312 is a natural phosphonate inhibitor of enolase". Nature Chemical Biology. 12 (12): 1053–1058. doi:10.1038/nchembio.2195. PMC 5110371. PMID 27723749.
- ^ Ramachandran, V. S.; Lowery, M. S.; Wise, T.; Polomark, G. M. (1993). "The role of phosphonates in the hydration of Portland cement". Materials and Structures. 26 (7): 425–432. doi:10.1007/BF02472943. ISSN 0025-5432.
- ^ Collier, Nicholas C.; Milestone, Neil B.; Travis, Karl P.; Gibb, Fergus.G.F. (2016). "The effect of organic retarders on grout thickening and setting during deep borehole disposal of high-level radioactive waste". Progress in Nuclear Energy. 90: 19–26. doi:10.1016/j.pnucene.2016.02.021. ISSN 0149-1970.
- ^ Flatt, R.; Schober, I. (2012). "Superplasticizers and the rheology of concrete". Understanding the Rheology of Concrete. str. 144–208. doi:10.1533/9780857095282.2.144. ISBN 9780857090287.
- ^ Wiemer, AJ; Hohl, RJ; Wiemer, DF (juni 2009). "The intermediate enzymes of isoprenoid metabolism as anticancer targets". Anti-Cancer Agents in Medicinal Chemistry. 9 (5): 526–42. doi:10.2174/187152009788451860. PMID 19519294.
- ^ Huang J, Su Z, Xu Y (novembar 2005). "The evolution of microbial phosphonate degradative pathways". Journal of Molecular Evolution. 61 (5): 682–90. Bibcode:2005JMolE..61..682H. doi:10.1007/s00239-004-0349-4. PMID 16245012.
- ^ Nowack Bernd (2003). "Environmental chemistry of phosphonates". Water Research. 37 (11): 2533–2546. doi:10.1016/S0043-1354(03)00079-4. PMID 12753831.
Dopunska literatura
[uredi | uredi izvor]- Newman R.H., Tate K.R. (1980). "Soil characterized by 31P nuclear magnetic resonance". Communications in Soil Science and Plant Analysis. 11: 835–842. doi:10.1080/00103628009367083.
- Abhimanyu S. Paraskar; Arumugam Sudalai (2006). "A novel Cu(OTf)2 mediated three component high yield synthesis of
α -aminophosphonates" (PDF). Arkivoc (1838EP): 183–9. - Singh R, Nolan SP (novembar 2005). "Synthesis of phosphorus esters by transesterification mediated by N-heterocyclic carbenes (NHCs)". Chemical Communications (43): 5456–8. doi:10.1039/b509783e. PMID 16261245.


