Peroxynitrit
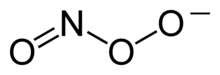

Peroxynitrit je anion se vzorcem ONOO−. Je to nestabilní valenční izomer aniontu NO3−, který má stejný sumární vzorec, ale odlišnou strukturu. Ačkoliv je kyselina peroxynitridová vysoce reaktivní, její konjugovaná báze peroxynitrit je stabilní.[1] Vyrábí se reakcí peroxidu vodíku s dusitanem:
- H2O2 + NO2− → ONOO− + H2O
Peroxynitrit je oxidační a nitrační činidlo. Díky svým oxidačním vlastnostem může napadat široké spektrum biomolekul v buňkách, včetně DNA a bílkovin. Formování peroxynitritu in vivo je přičítáno reakci volných radikálů peroxidu s volnými radikály oxidu dusnatého.[2]:
- ·O2− + ·NO → ONO2−
Produktem reakce těchto dvou radikálů je peroxinitrit, molekula, která sama o sobě není radikálem, ale má silné oxidační vlastnosti.
V laboratoři může být roztok peroxynitritu připraven reakcí okyseleného peroxidu vodíku s roztokem dusitanu sodného, a následovaným rychlým přidáním hydroxidu sodného. Koncentrace je indikována absorbancí při 302 nm (pH 12,
Peroxynitrit (spíše než NO·) je in vivo odpovědný za nitraci a hydroxylaci aminokyseliny tyrozinu. Přechodné kovy včetně kovů v aktivních centrech superoxiddizmutázy a myeloperoxidázy katalyzují jeho heterolytické štěpení na hydroxidový anion a nitroniový kation, jež je schopen napadat fenolické sloučeniny (in vivo například tyrozin na 3-nitrotyrozin).
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Peroxynitrite na anglické Wikipedii.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Pacher, P.; Beckman, J. S.; Liaudet, L.; “Nitric Oxide and Peroxynitrite: in Health and disease” Physiological Reviews 2007, volume 87(1), page 315-424. PMID 17237348
- ↑ Beckman, J. S.; Koppenol, W. H. “Nitric Oxide, Superoxide, and Peroxynitrite: the Good, the Bad, and Ugly” American Journal of Physiology- Cell Physiology 1996, volume 271, page C1424-C1437.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Peroxynitrit na Wikimedia Commons
Obrázky, zvuky či videa k tématu Peroxynitrit na Wikimedia Commons
