„Borneole“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Balu16 (Diskussion | Beiträge) K Erster Link von *Campher* |
linkfix |
||
| Zeile 2: | Zeile 2: | ||
== Vorkommen == |
== Vorkommen == |
||
Als [[ |
Als [[sekundäre Pflanzenstoffe]] sind die Borneole Bestandteile vieler [[Ätherisches Öl|ätherischer Öle]]. (+)-Borneol (Borneo Camper) findet man hauptsächlich im ätherischen Öl von Drybalanops camphora, einem auf Sumatra und Borneo heimischen Baum. Hingegen findet man (–)-Borneol (Ngai Camper) in [[Echter Koriander|Korianderöl]], Baldrianöl, Citronellöl, Thujaöl und anderen ätherischen Ölen.<ref name=Gossauer>Albert Gossauer: ''Struktur und Reaktivität der Biomoleküle'', Verlag Helvetica Chimica Acta, Zürich, 2006, S. 206, ISBN 978-3-906390-29-1.</ref> |
||
== Vertreter == |
== Vertreter == |
||
Version vom 23. August 2015, 10:49 Uhr
Die Borneole sind eine in der Natur vorkommende Gruppe chemischer Verbindungen. Die isomeren Vertreter sind feste, farblose Substanzen, die strukturell einwertige, sekundäre Alkohole aus der Stoffklasse der bicyclischen Monoterpene sind.
Vorkommen
Als sekundäre Pflanzenstoffe sind die Borneole Bestandteile vieler ätherischer Öle. (+)-Borneol (Borneo Camper) findet man hauptsächlich im ätherischen Öl von Drybalanops camphora, einem auf Sumatra und Borneo heimischen Baum. Hingegen findet man (–)-Borneol (Ngai Camper) in Korianderöl, Baldrianöl, Citronellöl, Thujaöl und anderen ätherischen Ölen.[1]
Vertreter
Die Molekülstruktur der Borneole enthält chirale Kohlenstoffatome und kommt daher in zwei diastereomeren Formen vor, die üblicherweise Borneol und Isoborneol genannt werden. Da jede dieser beiden Formen ein (enantiomeres) Spiegelbild hat, existieren insgesamt vier Stereoisomere von denen jeweils zwei enantiomer zueinander sind und die Racemate (±)-Borneol und (±)-Isoborneol bilden:
| Isomere von Borneol | |||||||||||||
| Name | (+)-Borneol | (−)-Borneol | (+)-Isoborneol | (−)-Isoborneol | |||||||||
| IUPAC-Name | (1R,2S,4R)-1,7,7-Trimethyl- bicyclo[2.2.1]heptan-2-ol |
(1S,2R,4S)-1,7,7-Trimethyl- bicyclo[2.2.1]heptan-2-ol |
(1S,2S,4S)-4,7,7-Trimethyl- bicyclo[2.2.1]heptan-2-ol |
(1R,2R,4R)-4,7,7-Trimethyl- bicyclo[2.2.1]heptan-2-ol | |||||||||
| andere Namen |
endo-Borneol |
exo-Isoborneol | |||||||||||
|
2-Borneol | |||||||||||||
| Strukturformel | 
|

|

|
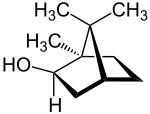
| |||||||||
| CAS-Nummer | 464-43-7 | 464-45-9 | 16725-71-6 | 10334-13-1 | |||||||||
| 507-70-0 (Racemat) | 124-76-5 (Racemat) | ||||||||||||
| PubChem | 6552009 | 1201518 | 6321405 | ? | |||||||||
| ? (Racemat) | 24900674 (Racemat) | ||||||||||||
| Summenformel | C10H18O | ||||||||||||
| Molare Masse | 154,25 g·mol−1 | ||||||||||||
| Aggregatzustand | fest | ||||||||||||
| Kurzbeschreibung | farbloser, geruchloser Feststoff[2] | kristalliner, weißer Feststoff[3] | kristalliner, weißer Feststoff[4] mit angenehmen[4] Geruch nach Vanille und Holz[5] | ||||||||||
| Schmelzpunkt[6] | 208–209 °C | 208–209 °C | 212–214 °C | 212–214 °C | |||||||||
| 212 °C Racemat | 210–215 °C Racemat | ||||||||||||
| Optischer Drehwert [ |
+ 37,7° [1] | − 37,7° [1] | + 34,1° [7] | − 33,6° [7] | |||||||||
| Löslichkeit | unlöslich in Wasser[2] | unlöslich in Wasser[3] | unlöslich in Wasser[4] | ||||||||||
| GHS- Kennzeichnung |
|
|
| ||||||||||
| H-Sätze | 228 | 228 | 315‐319‐335 | ||||||||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | |||||||||||
| P-Sätze | 210‐280[2] | 210‐240‐241‐280‐370+378[3] | 261‐302+352‐305+351+338‐321[4] | ||||||||||
| Gefahrstoff- kennzeichnung |
|
|
| ||||||||||
| R-Sätze | 11 | 11 | 36/37/38 | ||||||||||
| S-Sätze | 26‐37 | ||||||||||||
| Toxikologische Daten | 5800 mg·kg−1 (LD50, Ratte, oral)[3] |
1750 mg·kg−1 (LD50, Maus, oral)[4] | |||||||||||
Herstellung
Borneol kann durch Meerwein-Ponndorf-Verley-Reduktion von Campher erhalten werden.[8] Bei der Reduktion von Campher mit Natriumborhydrid oder Lithiumaluminiumhydrid hingegen entsteht vorwiegend das Stereoisomer Isoborneol:[9]
- Diastereoselektivität der Reduktion von (1R,4R)-(+)-Campher zu (1R,2R,4R)-Isoborneol (ca. 95 %) und (1R,2S,4R)-Borneol (ca. 5 %).
Chemische Eigenschaften
Borneol kann mit Chromsäure oder Salpetersäure zu Campher oxidiert werden. Dehydratation mit verdünnten Säuren führt zu Camphen.
Mit Acetanhydrid kann es zum Bornylacetat verestert werden.
Die bakterielle Biosynthese von 2-Methylisoborneol haben Forscher der TU Braunschweig mit dem Helmholtz-Zentrum für Infektionsforschung in Braunschweig und der Uni Saarbrücken erforscht.[10]
Verwendung

Als Bestandteil von ätherischen Ölen ist Borneol mitverantwortlich für Geruch und Geschmack diverser Gewürze. Dergestalt wird es auch in Kosmetika eingesetzt.
Derivate des Borneols, wie (2S)-(−)-exo-(Dimethylamino)isoborneol (DAIB) werden in der modernen asymmetrischen Synthese genutzt.[11]
Struktur
-
Stäbchenmodell von (S)-Borneol
-
Stäbchenmodell von (S)-Isoborneol
Literatur
- H. Surburg und J. Panten: Common Fragrance and Flavor Materials: preparation, properties, and uses. Wiley-VCH, Weinheim 2006, ISBN 3-527-31315-X.
Einzelnachweise
- ↑ a b c Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 206, ISBN 978-3-906390-29-1. Referenzfehler: Ungültiges
<ref>-Tag. Der Name „Gossauer“ wurde mehrere Male mit einem unterschiedlichen Inhalt definiert. - ↑ a b c d e Datenblatt (+)-Borneol (PDF) bei Carl Roth
- ↑ a b c d e f Datenblatt (–)-Borneol bei Alfa Aesar (Seite nicht mehr abrufbar).
- ↑ a b c d e f g h Datenblatt (±)-Isoborneol bei Alfa Aesar (Seite nicht mehr abrufbar).
- ↑ Datenblatt (±)-Isoborneol bei Sigma-Aldrich (PDF).
- ↑ Eintrag zu Borneole. In: Römpp Online. Georg Thieme Verlag
- ↑ a b Hamada, Hiroki, Bull. Chem. Soc. Jpn. 61 (1988) 869-878.
- ↑ Ashok Pandey: Industrial Biorefineries & White Biotechnology. Elsevier, 2015, ISBN 978-0-444-63464-1, S. 132 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jonathan Clayden, Nick Greeves, Stuart Warren, Peter Wothers: Organic Chemistry, Orford University Press, 2001, S. 862. ISBN 978-0-19-850346-0.
- ↑ Biosynthesis of the Off-flavor 2-Methylisoborneol by the Myxobacterium Nannocystis exedens in: Angew. Chem. 2007, 119, 8436–8439.
- ↑ James D. White, Duncan J. Wardrop, and Kurt F. Sundermann: (2S)-(−)-exo-(dimethylamino)isoborneol [(2S)-(−)-DAIB] In: Organic Syntheses. 79, 2002, S. 130, doi:10.15227/orgsyn.079.0130 (PDF).






