„Praseodym“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
→Preise: Aktualisierung Markierung: Zurückgesetzt |
Andol (Diskussion | Beiträge) Entfernt, klare Werbung, siehe heute Löschkandidaten Markierung: Manuelle Zurücksetzung |
||
| Zeile 237: | Zeile 237: | ||
Praseodymium(III)-chloride-heptahydrate.jpg|Praseodym(III)-chlorid Heptahydrat |
Praseodymium(III)-chloride-heptahydrate.jpg|Praseodym(III)-chlorid Heptahydrat |
||
</gallery> |
</gallery> |
||
== Preise == |
|||
Der Preis für 1 Kilogramm ''Praseodym 99%'' (FOB China) lag seit 2001 zumeist weit unter 50 [[US-Dollar|USD]]. Er stieg Anfang 2011 auf 250 USD mit Jahresspitzenwert um 280 USD und stand im Januar 2012 wieder bei 250 USD. Parallel die Preisentwicklung für eine [[Metrische Tonne|Mt]] [1000 kg] ''Praseodymoxid 99%'' (FOB China): 2001 bis Mitte 2010 zumeist weit unter 50.000 USD, 2011 von 220.000 bis 250.000 USD, Anfang Januar 2012 bei 170.000 USD.<ref>Angaben und Schreibweise: Webseite ''[[Institut für Seltene Erden und Metalle]] (ISE)'': [https://institut-seltene-erden.de/seltene-erden-und-metalle/seltene-erden/praseodym/ Praseodym]. Abgerufen am 2. August 2022.</ref> Die Durchschnittspreise für die letzten sechs Monate (Februar bis Juli 2022) gibt das Institut wie folgt an: „Praseodymium Metal – 99.5% FOB China: 182,16 EUR/kg“ sowie: „Praseodymium Oxide – 99.5% FOB China: 134.750 EUR/mt“.<ref>Angaben und Schreibweise: Webseite ''ISE'': [https://ise-metal-quotes.com/ Metal Quotes]. Abgerufen am 2. August 2022.</ref> |
|||
== Weblinks == |
== Weblinks == |
||
Version vom 29. November 2022, 21:16 Uhr
| Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Praseodym, Pr, 59 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Lanthanoide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | La, 6, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | silbrig weiß, gelblicher Farbton | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-120-3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.291 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 5,2 ppm[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 140,90766(1)[3] u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 185 (247) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 203 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Xe] 4f3 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 5.4702(4) eV[4] ≈ 527.79 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 10.631(20) eV[4] ≈ 1025.7 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 21.6237(25) eV[4] ≈ 2086.37 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 38.981(25) eV[4] ≈ 3761.1 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 57.53(5) eV[4] ≈ 5550 kJ/mol[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 6,475 g/cm3 (25 °C)[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | paramagnetisch ( | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1208 K (935 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 3403 K[8] (3130 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 20,80 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 331 kJ/mol[8] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 6,9 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 2280 m·s−1 bei 293,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 1,43 · 106 S·m−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 13 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 3, 4, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −2,35 V (Pr3+ + 3 e− → Pr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,13 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Praseodym ist ein chemisches Element mit dem Elementsymbol Pr und der Ordnungszahl 59. Im Periodensystem steht es in der Gruppe der Lanthanoide und zählt damit auch zu den Metallen der Seltenen Erden. Von der Grünfärbung seiner Verbindungen kommt auch der Name: das griechische Wort πράσινος prásinos bedeutet „grün“, δίδυμος didymos „doppelt“ oder „Zwilling“.
Geschichte

1841 extrahierte Carl Gustav Mosander die Seltene Erde Didym aus Lanthanoxid. 1874 bemerkte Per Teodor Cleve, dass es sich bei Didym eigentlich um zwei Elemente handelte. Im Jahr 1879 isolierte Lecoq de Boisbaudran Samarium aus Didym, das er aus dem Mineral Samarskit gewann. 1885 gelang es Carl Auer von Welsbach, Didym in Praseodym und Neodym zu trennen, die beide Salze mit verschiedenen Farben bilden.[10]
Vorkommen
Praseodym kommt in natürlicher Form nur in chemischen Verbindungen vergesellschaftet mit anderen Lanthanoiden, hauptsächlich in den Mineralien
|
vor.
Die weltweiten Reserven werden auf 4 Millionen Tonnen geschätzt.
Gewinnung und Herstellung
Wie bei allen Lanthanoiden werden zuerst die Erze durch Flotation angereichert, danach die Metalle in entsprechende Halogenide umgewandelt und durch fraktionierte Kristallisation, Ionenaustausch oder Extraktion getrennt.
Das Metall wird durch Schmelzflusselektrolyse oder Reduktion mit Calcium gewonnen.
Eigenschaften
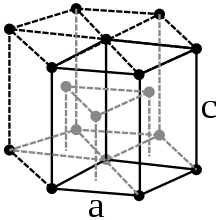
Physikalische Eigenschaften
Praseodym ist ein weiches, silberweißes paramagnetisches Metall, welches zu den Lanthanoiden und Metallen der Seltenen Erden gehört. Bei 798 °C wandelt sich das hexagonale
Chemische Eigenschaften
Bei hohen Temperaturen verbrennt Praseodym zum Sesquioxid Pr2O3. Es ist in Luft etwas korrosionsbeständiger als Europium, Lanthan oder Cer, bildet aber leicht eine grüne Oxidschicht aus, die an der Luft abblättert. Mit Wasser reagiert es unter Bildung von Wasserstoff zum Praseodymhydroxid (Pr(OH)3). Praseodym tritt in seinen Verbindungen drei- und vierwertig auf, wobei die dreiwertige Oxidationszahl die häufigere ist. Pr(III)-Ionen sind gelbgrün, Pr(IV)-Ionen gelb. Unter besonderen reduktiven Bedingungen kann auch zweiwertiges Praseodym erzeugt werden, z. B. im Praseodym(II,III)-iodid (Pr2I5).
Isotope
Natürliches Praseodym besteht nur aus dem stabilen Isotop 141Pr. 38 weitere radioaktive Isotope sind bekannt, wobei 143Pr und 142Pr mit einer Halbwertszeit von 13,57 Tagen beziehungsweise 19,12 Stunden die langlebigsten sind. Alle anderen Isotope haben Halbwertszeiten von weniger als 6 Stunden, die meisten sogar weniger als 33 Sekunden. Es gibt auch 6 metastabile Zustände, wobei 138mPr (t½ 2,12 Stunden), 142mPr (t½ 14,6 Minuten) und 134mPr (t½ 11 Minuten) die stabilsten sind.
Die Isotope bewegen sich in einem Atommassenbereich von 120,955 (121Pr) bis 158,955 (159Pr).
Verwendung
- Praseodym wird in Legierungen mit Magnesium zur Herstellung von hochfestem Metall für Flugzeugmotoren verwendet.
- Legierungen mit Cobalt und Eisen sind starke Dauermagnete.
- Praseodymverbindungen werden zum Färben von Glas und Emaille verwendet (zum Beispiel in grün gefärbten Scheinwerfergläsern in der Beleuchtungstechnik).
- Die Verbindungen verbessern auch die UV-Absorption und werden für Augenschutzgläser beim Schweißen benutzt.
- Das Praseodym-Ion Pr3+ wird als Dotant für Lasermedien in Feststofflasern verwendet. So kommt es beispielsweise in Pr3+:LiYF4-Lasern vor.
Verbindungen
Oxide
- grünes Praseodym(III)-oxid (Pr2O3)
- braun-schwarzes Praseodym(III,IV)-oxid (Pr6O11)
- fast schwarzes Praseodym(IV)-oxid (PrO2)
Halogenide
Bekannt sind von allen Oxidationsstufen mehrere Halogenide beispielsweise Praseodym(III)-fluorid (PrF3), Praseodym(IV)-fluorid (PrF4), Praseodym(III)-chlorid (PrCl3), Praseodym(III)-bromid (PrBr3), Praseodym(III)-iodid (PrI3), Praseodym(II,III)-iodid (Pr2I5). Die dreiwertigen Halogenide bilden verschiedene Hydrate.
Außerdem bildet es mehrere Fluoridokomplexe wie z. B. das K2[PrF6] mit vierwertigem Pr.
Andere Verbindungen
Binäre Verbindungen sind z. B. Praseodym(III)-sulfid (Pr2S3), Praseodymnitrid (PrN), Praseodymphosphid (PrP).
Daneben ist Praseodym in diversen Salzen, wie dem hygroskopischen Praseodym(III)-nitrat (Pr(NO3)3 · x H2O), dem schön kristallisierenden Praseodym(III)-sulfat (Pr2(SO4)3 · 8 H2O) und anderen vertreten.
Eine Übersicht über Praseodymverbindungen bietet die Kategorie:Praseodymverbindung.
-
Praseodym(III)-sulfat Octahydrat
-
Praseodym(III)-chlorid Heptahydrat
Weblinks
- Eintrag zu Praseodym. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
- Metallisch blankes Praseodym
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Praseodym) entnommen.
- ↑ IUPAC Commission on Isotopic Abundances and Atomic Weights: Standard Atomic Weights of 14 Chemical Elements Revised. In: Chemistry International. 40, 2018, S. 23, doi:10.1515/ci-2018-0409.
- ↑ a b c d e Eintrag zu praseodymium in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- ↑ a b c d e Eintrag zu praseodymium bei WebElements, www.webelements.com, abgerufen am 11. Juni 2020.
- ↑ N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1579.
- ↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337; doi:10.1021/je1011086.
- ↑ a b Datenblatt Praseodymium, powder bei Sigma-Aldrich, abgerufen am 26. April 2017 (PDF).
- ↑ Carl Auer v. Welsbach: Die Zerlegung des Didyms in seine Elemente. In: Monatshefte für Chemie. 6 (1), 1885, S. 477–491; doi:10.1007/BF01554643.



