Selenomethionin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Strukturformel ohne Angabe der Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Selenomethionin | ||||||||||||||||||
| Andere Namen |
2-Amino-4-(methylselenyl)buttersäure | ||||||||||||||||||
| Summenformel | C5H11NO2Se | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 196,1 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Selenomethionin ist eine
Stereochemie
Selenomethionin besitzt ein Stereozentrum, somit existieren zwei Enantiomere. Ist der Name ‚Selenomethionin‘ durch keinen Deskriptor näher gekennzeichnet, ist L-Selenomethionin [Synonym: (S)-Selenomethionin] gemeint.
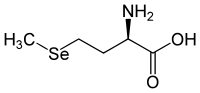
D-Selenomethionin [Synonym: (R)-Selenomethionin] ist das Enantiomer von L-Selenomethionin und kommt in der Natur nicht vor.
| Enantiomere von Selenomethionin | ||
| Name | L-Selenomethionin | D-Selenomethionin |
| Andere Namen | (S)-Selenomethionin | (R)-Selenomethionin |
| Strukturformel | 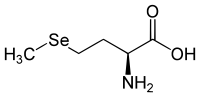
|
|
| CAS-Nummer | 3211-76-5 | 13091-98-0 |
| 1464-42-2 (unspez.) | ||
| EG-Nummer | 608-705-0 | – |
| 215-977-0 (unspez.) | ||
| ECHA-Infocard | 100.123.183 | – |
| 100.014.525 (unspez.) | ||
| PubChem | – | 5460538 |
| 15103 (unspez.) | ||
| DrugBank | DB11142 | − |
| − (unspez.) | ||
| Wikidata | Q27096144 | Q27110364 |
| Q415925 (unspez.) | ||
Eigenschaften
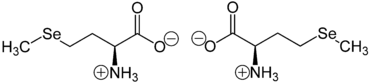
Selenomethionin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe zum einsamen Elektronenpaar des Stickstoffatoms der Aminogruppe wandert:
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Selenomethionin auch seine geringste Löslichkeit in Wasser besitzt. Selenomethionin zählt nicht zu den essentiellen Aminosäuren.
Synthese
Zur Synthese von racemischem Selenomethionin geht man aus von
![Synthese von (RS)-Selenomethionin.[2]](https://upload.wikimedia.org/wikipedia/commons/thumb/8/82/Selenomethionine_synthesis_v.2.png/480px-Selenomethionine_synthesis_v.2.png)
Verwendung
L-Selenomethionin wird in der Röntgenstrukturanalyse von Proteinen verwendet. Hierbei wird während der rekombinanten Proteinsynthese Selenomethionin statt Methionin in die Proteine eingebaut. Dies dient der Lösung des Phasenproblems (Patterson-Methode).[3]
L-Selenomethionin wird auch zur Versorgung des Menschen mit dem Spurenelement Selen genutzt: Dazu wird diese Aminosäure an Hefen verfüttert, die Hefen wiederum werden zu pharmazeutischen Präparaten weiter prozessiert.
Sonstiges
- Abkürzung: SeMet, Sem
- Restname: Selenomethionyl-
- Seitenkette: lipophil
Siehe auch
Einzelnachweise
- ↑ a b c Datenblatt Seleno-L-methionine bei Sigma-Aldrich, abgerufen am 23. April 2011 (PDF).
- ↑ a b X. G. Ran, D. R. Cao, L. Y. Wang, Y. C. Lin: A Convenient Synthesis of D,L-Selenomethionine, Polish J. Chem. 83 (2009) 431–435.
- ↑ Michael Pieper, Michael Betz, Nediljko Budisa, Franz-Xaver Gomis-Rüth, Wolfram Bode, Harald Tschesche: Expression, Purification, Characterization, and X-Ray Analysis of Selenomethionine 215 Variant of Leukocyte Collagenase, in: J Protein Chem., 1997, 16 (6), S. 637–650; PMID 9263126; doi:10.1023/A:1026327125333.


