4-Pentylphenol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
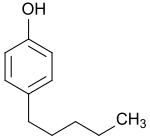
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4-Pentylphenol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C11H16O | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 164,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
sehr gut löslich in Diethylether und Ethanol[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
4-Pentylphenol ist eine häufig vorkommende Vorstufe für meist nematische Flüssigkristalle, wie z. B. substituierte Phenylcyclohexane, die als Mischungskomponenten für LC-Displays weite Verbreitung gefunden haben.[5]
Vorkommen und Darstellung
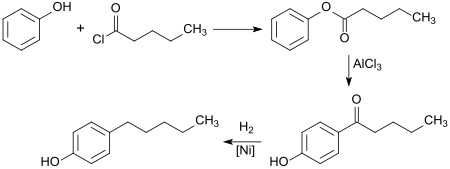
[Bearbeiten | Quelltext bearbeiten]4-Pentylphenol entsteht in einer mehrstufigen Synthese aus Phenol und Pentanoylchlorid (Valeroylchlorid)[6], wobei zunächst durch O-Acylierung nach der Schotten-Baumann-Methode Phenylvalerat gebildet, das in Gegenwart von Aluminiumchlorid (AlCl3) bei 100 °C in einer Fries-Verschiebung zum 4‘-Hydroxyvalero-phenon (4-Pentanoylphenol)[7] umgelagert wird. In einer Eintopfreaktion in Trifluormethansulfonsäure als Lösungsmittel und Katalysator kann das C-Acylierungsprodukt 4-Pentanoylphenol direkt erhalten werden.[8]
Anschließend wird die Carbonylgruppe, z. B. durch katalytische Hydrierung oder durch Wolff-Kishner-Reaktion zum Alkan reduziert.
Bei der Umlagerung der Doppelbindungen in 4-(4-Pentenyl)-2-cyclohexenon mittels Rhodium(III)-chlorid-Trihydrat entsteht 4-n-Pentylphenol in 62 %iger Ausbeute.[9]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Reines 4-Pentylphenol ist ein weißes Kristallpulver, das sich gut in Ethanol und Diethylether löst.[4] Sein Geruch wird als pilzartig und metallisch (engl. mushroom-like and metallic) beschrieben.[10]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]4-Pentylphenol ist Ausgangsverbindung für stäbchenförmige Moleküle, die wegen ihrer Fähigkeit zur Ausbildung thermotroper Mesophasen als Mesogene in Anzeigeelementen und Bildschirmen – meist als Bestandteil komplexer Mischungen (zur Schmelzpunktserniedrigung) mit oft mehr als zehn Komponenten – verwendet werden.
Dazu wird 4-Pentylphenol durch katalytische Hydrierung, z. B. an Raney-Nickel[11] oder Platin(IV)-oxid (PtO2)[12] in 4-Pentylcyclohexanol überführt, das als Isomerengemisch von 65 % trans- und 35 % cis-Konfiguration vorliegt.[11]

Der racemische Ester von 4-Pentylcyclohexanol mit der chiralen smektischen Mesogen 4-(2-Methylbutyl)-4‘-biphenylcarbonsäure führt zusammen mit anderen stäbchenförmigen Molekülen zu LC-Mischungen mit deutlich verbreiterten nematischen Phasen in für LC-Displays bevorzugten Temperaturbereichen.[11]

4-Pentylcyclohexanol kann durch Jones-Oxidation mit Chrom(VI)-oxid (CrO3) bzw. Natriumdichromat (Na2Cr2O7) zum 4-Pentylcyclohexanon[13] oxidiert werden.[12] Wesentlich unproblematischer und ökonomischer ist die Dehydrierung mittels Cobalt-[14] oder Kupfer-Katalysatoren.[15]
Über einen mehrstufigen Syntheseweg können aus 4-Pentylcyclohexanon 4-(trans-4‘-Pentylcyclohexyl)benzoesäurederivate aufgebaut werden, die – im Gegensatz z. B. zu Biphenylderivaten – allein oder bevorzugt in Mischungen mit anderen Mesogenen auch bei tiefen Temperaturen flüssig sind, nematische Phasen ausbilden und wegen ihrer niedrigen Viskositäten kurze Schaltzeiten in LC-Anzeigen aufweisen. Modellverbindung ist das auch als PCH-5 bezeichnete 4-(trans-4′-Pentylcyclohexyl)benzonitril.[12][16]

In einem im gleichen Jahr angemeldeten Patent der Chisso Corp.[17] wird 4-Pentylphenol über 4-Pentylcyclohexanon mit 1,4-Dibrombenzol (X = Br) zur bromierten Cyclohexenylverbindung umgesetzt, aus der mit Kupfer(I)-cyanid (CuCN) direkt das Cyclohexenylbenzonitril (oder Cyanphenylcyclohexen) zugänglich ist.
Das auf 4-Pentylphenol als Ausgangsstoff basierende PCH-5 und Analoga ermöglichte die ab den 1980er Jahren erfolgreichen TN-LCDs (TN = engl. twisted nematic) – auch als Schadt-Helfrich-Zelle bezeichneten – Flüssigkristallanzeigen mit brauchbaren Arbeitstemperaturen und hohen Lebensdauern.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Ayyalusamy Ramamoorthy, Ed.: Thermotropic Liquid Crystals – Recent Advances. 1. Auflage, Springer, Doordrecht, NL 2007, ISBN 978-1-4020-5327-6.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu 4-Amylphenol bei TCI Europe, abgerufen am 31. März 2022.
- ↑ a b c Datenblatt 4-Pentyl-phenol bei Sigma-Aldrich, abgerufen am 19. März 2022 (PDF).
- ↑ Datenblatt 4-n-Pentylphenol, 98% bei Alfa Aesar, abgerufen am 29. März 2022 (Seite nicht mehr abrufbar).
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 92th Edition. CRC Press, Boca Raton, FL, U.S.A. 2012, ISBN 978-1-4398-5512-6, S. 3–442.
- ↑ Flüssigkristalldisplay-Technologien. Merck KGaA, 2021, abgerufen am 22. März 2022.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu pentanoyl chloride: CAS-Nr.: 638-29-9, EG-Nr.: 211-330-1, ECHA-InfoCard: 100.010.301, GESTIS: 510708, PubChem: 61186, ChemSpider: 55132, Wikidata: Q48996224.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 4-Hydroxyvalerophenone: CAS-Nr.: 2589-71-1, EG-Nr.: 219-978-7, ECHA-InfoCard: 100.018.163, PubChem: 75766, ChemSpider: 68277, Wikidata: Q72482153.
- ↑ R. Murashige, Y. Hayashi, S. Ohmori, A. Torii, Y. Aizu, Y. Muto, Y. Murai, Y. Oda, M. Hashimoto: Comparisons of O-acylation and Friedel–Crafts acylation of phenols and acyl chlorides and Fries rearrangement of phenyl esters in trifluoromethanesulfonic acid: effective synthesis of optically active homotyrosines. In: Tetrahedron. Band 67, Nr. 3, 2011, S. 641–649, doi:10.1016/j.tet.2010.11.047.
- ↑ P.A. Grieco, N. Marinovic: Rhodium-catalyzed migration of double bonds: Preparation of substituted phenols and anilines. In: Tetrahedron Lett. Band 19, Nr. 29, 1978, S. 2545–2548, doi:10.1016/S0040-4039(01)94288-1.
- ↑ M. Czerny, R. Brückner, E. Kirchhoff, R. Schmitt, A. Büttner: The influence of molecular structure on odor qualities and odor detection thresholds of volatile alkylated phenols. In: Chem. Senses. Band 36, Nr. 6, 2011, S. 539–553, doi:10.1093/chemse/bjr009.
- ↑ a b c Patent US4341653: Liquid-crystalline 4-alkylcyclohexyl esters. Angemeldet am 26. Februar 1981, veröffentlicht am 27. Juli 1982, Anmelder: Chisso Corp., Erfinder: T. Inukai, K. Furukawa, S. Sugimori, H. Sato.
- ↑ a b c Patent US4130502: Liquid crystalline cyclohexane derivatives. Angemeldet am 10. August 1977, veröffentlicht am 19. Dezember 1978, Anmelder: Merck Patent Ges. mbH, Erfinder: R. Eidenschink, J. Krause, L. Pohl.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 4-Pentylcyclohexanone: CAS-Nr.: 61203-83-6, EG-Nr.: 406-670-4, GESTIS: 530940, PubChem: 566097, ChemSpider: 492098, Wikidata: Q72500176.
- ↑ Y. Uemichi, K. Shouji, M. Sugioka, T. Kanazuka: Highly effective dehydrogenation of cyclohexanol to cyclohexanone over carbon-supported cobalt catalyst. In: Bull. Chem. Soc. Jpn. Band 68, Nr. 1, 1995, S. 385–387, doi:10.1246/bcsj.68.385.
- ↑ B. Sridevi, P. Nagaiah, A.H. Padmasri, B. David Raju, K.S. Rama Rao: Studies on dehydrogenation of cyclohexanol to cyclohexanone over mesoporous SiO2 supported copper catalysts. In: J. Chem. Sci. Band 129, Nr. 5, 2017, S. 601–608, doi:10.1007/s12039-017-1271-9.
- ↑ R. Eidenschink, D. Erdmann, J. Krause, L. Pohl: Substituierte Substituierte Phenylcyclohexane - eine neue Klasse flüssigkristalliner Verbindungen. In: Angew. Chem. Band 89, Nr. 2, 1977, S. 103–103, doi:10.1002/ange.19770890208.
- ↑ Patent EP0002136B1: Substituted benzonitriles, their preparation, liquid crystal compositions containing them and display devices employing such compositions. Angemeldet am 21. November 1978, veröffentlicht am 21. Oktober 1981, Anmelder: Chisso Corp., Erfinder: H. Sato, K. Furukawa, S. Sugimori.

