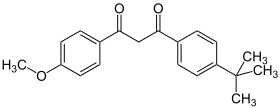
Avobenzon
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Avobenzon | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C20H22O3 | |||||||||||||||||||||
| Kurzbeschreibung | ||||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 310,39 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Avobenzon (deutscher INN[7]; meist wird auch im Deutschen der englische INN Avobenzone verwendet) ist ein substituiertes 1,3-Diketon.
Mit seinem Absorptionsmaximum bei 357 nm[8] ist Avobenzon ein wirksames UV-A-Sonnenschutzmittel, das UV-Strahlung effektiv absorbiert und die Bildung freier Radikale wirksam unterdrückt. Avobenzon wird weltweit verwendet und ist der einzige derzeit in den USA in Sonnenschutzmitteln zugelassene organische UV-Absorber mit Absorption im längerwelligen UVA-Bereich (315–380 nm).[9]
Herstellung
[Bearbeiten | Quelltext bearbeiten]In einer Claisen-Kondensation reagiert 4-tert-Butylbenzoesäuremethylester (aus 4-tert-Butylbenzoesäure durch Veresterung mit Methanol) mit 4-Methoxyacetophenon in Toluol und in Gegenwart von Natriumamid in 71%iger Ausbeute zu 4-tert-Butyl-4′-methoxydibenzoylmethan:[10]

Nach einer neueren Patentanmeldung[11] werden mit den gleichen Edukten in Toluol in Gegenwart von Kaliummethanolat Ausbeuten bis 95 % erzielt.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Reines Avobenzon ist ein weißliches bis gelbliches kristallines Pulver mit schwachem Geruch,[12] das sich in Isopropanol, Decyloleat, Caprinsäure-/Caprylsäure-triglyceriden und anderen Ölen löst.
Als Enolat bildet Avobenzon mit Schwermetallionen, wie z. B. Fe3+ gefärbte Komplexe, zu deren Unterdrückung Chelatbildner wie z. B. EDTA zugesetzt werden können. Stearate, Aluminium-, Magnesium- und Zinksalze können zu schwerlöslichen Niederschläge führen.[12]
Es unterliegt einer Keto-Enol-Tautomerie und liegt überwiegend als Enol vor:[13]

In Abhängigkeit von der Polarität der eingesetzten Lösungsmittel zeigt Avobenzon unterschiedliche Photostabilitäten.[13] In polaren Medien, die die Bildung intermolekularer Wasserstoffbrückenbindungen zwischen Avobenzon und dem Lösungsmittel fördern, ist Avobenzon photostabiler. In unpolaren Medien photoisomerisiert es in einen Triplet-Anregungszustand der Diketoform, der seine Energie auf andere Biomoleküle übertragen und diese schädigen kann. Die angeregte Ketoform photolysiert leicht unter Bindungsspaltung zu phototoxischen und photoallergischen Abbauprodukten.[14]
Durch die Photoreaktivität nimmt die UV-Absorption und damit der Lichtschutzeffekt von Avobenzon ab. Unter gebräuchlichen, lipophilen pharmazeutischen Grundlagen ist Avobenzon bei UV-Bestrahlung in Mineralöl und Isopropylmyristat am stabilsten.[15]
Der lichtinduzierte Abbau von Avobenzon lässt sich durch Zugabe von Photostabilisatoren, darunter auch photostabile organische UV-Filter wie z. B. Octocrilen,[9] die die Energie des angeregten Avonbenzon absorbieren, durch Antioxidantien wie z. B. Vitamin E, Vitamin C oder Ubichinon[16] bzw. durch Cyclodextrine[17] erheblich reduzieren.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Avobenzon ist der wichtigste UV-A-Filter in Sonnenschutzmitteln auf dem amerikanischen Markt. UV-Filter gelten in den USA als Arzneistoff (engl. Active Pharmaceutical Ingredients, API), daher unterliegen Sonnenschutzmittel als freiverkäufliche Arzneimittel (engl. OTC drugs) der Regulierung durch die amerikanische Arzneimittelbehörde (Food and Drug Administration, FDA) und den Richtlinien der Good Manufacturing Practice (cGMP). Seit der Zulassung von Avobenzon durch die FDA im Jahr 1988 wurde in den USA kein neuer UV-A-Absorber in den Markt eingeführt, weshalb ausschließlich Avobenzon in einer Maximalkonzentration von 3 % (Europa 5 %, bis zu 10 % in Japan) erlaubt ist.[18] Zur Erhöhung des Lichtschutzfaktors (engl. sun protection factor, SPF) müssen in Formulierungen daher Photostabilisatoren und zunehmend auch so genannte SPF-Booster eingesetzt werden.[19]
Auch Mischungen mit den anorganischen UV-Absorbern Titandioxid und Zinkoxid erhöhen den Lichtschutzfaktor und die UV-Stabilität von Avobenzon, allerdings muss die Oberfläche der TiO2-Partikel wegen ihrer hohen photokatalytischen Aktivität beschichtet werden.[20]
UV-Absorber wie Avobenzon werden wegen der Unterdrückung der Bildung freier Radikale in der Kosmetik auch als wirksam gegen Hautalterung (Anti-Aging), gegen Hautfalten (Anti-Wrinkle) und als entzündungshemmend (Anti-Inflammatory) propagiert.
Mit Bortrifluorid bildet Avobenzon stabile kristalline Komplexe, die unter UV-Bestrahlung fluoreszieren, wobei sie unter mechanischer Belastung einen (reversiblen) Farbwechsel vollziehen.[21]
Risikobewertung
[Bearbeiten | Quelltext bearbeiten]Avobenzon wurde 2015 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Avobenzon waren die Besorgnisse bezüglich Verbraucherverwendung, Umweltexposition, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der PBT-/vPvB-Stoffen. Die Neubewertung läuft seit 2015 und wird von Deutschland durchgeführt. Um zu einer abschließenden Bewertung gelangen zu können, wurden weitere Informationen nachgefordert.[22]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]- Neo Heliopan 357, Parsol 1789, Eusolex 9020
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu BUTYL METHOXYDIBENZOYLMETHANE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- ↑ a b c Datenblatt Avobenzone bei Sigma-Aldrich, abgerufen am 13. November 2021 (PDF).
- ↑ a b c Datenblatt Eusolex® 9020 bei Merck, abgerufen am 25. Juli 2015.
- ↑ a b c Eintrag zu 1-(4-(1,1-Dimethylethyl)phenyl)-3-(4-methoxyphenyl)propan-1,3-dion in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b c Kuhnert-Brandstätter, M.; Völlenklee, R.: Beitrag zur Polymorphie von Arzneistoffen, 4. Mitteilung: Oxamniquin, Resorantel, Spiperon, Suloctidil, Ticlopidinhydrochlorid, Parsol 1789 und Testosteroncyptonat in Sci. Pharm. 55 (1987) 27–39.
- ↑ a b LyondellBasell: Application Data, Solubility Screen, Ultraviolet Light Absorbers.
- ↑ Beschluss der Kommission vom 9. Februar 2006 zur Änderung des Beschlusses 96/335/EG der Kommission zur Festlegung einer Liste und einer gemeinsamen Nomenklatur der Bestandteile kosmetischer Mittel.
- ↑ G. Vielhaber, S. Grether-Beck, O. Koch, W. Johncock, J. Krutmann: Sunscreens with an absorption maximum of ≥360 nm provide optimal protection against UVA1-induced expression of matrix metalloproteinase-1, interleukin-1, and interleukin-6 in human dermal fibroblasts. In: Photochem. Photobiol. Sci. Band 5, 2006, S. 275–282, doi:10.1039/B516702G.
- ↑ a b D. G. Beasley, T. A. Meyer: Characterization of the UVA protection provided by avobenzone, zinc oxide, and titanium dioxide in broad-spectrum sunscreen products. In: American Journal of Clinical Dermatology. Band 11, Nr. 6, 2010, S. 413–421, doi:10.2165/11537050-000000000-00000 (englisch).
- ↑ Patent US4387089: 4-(1,1-Dimethylethyl)-4′-methoxydibenzoylmethane. Angemeldet am 18. Mai 1981, veröffentlicht am 7. Juni 1983, Anmelder: Givaudan Corp., Erfinder: K.-F. De Polo.
- ↑ Patent WO2012084770A1: Process for the manufacture of dibenzoylmethane derivatives. Angemeldet am 19. Dezember 2011, veröffentlicht am 28. Juni 2012, Anmelder: DSM IP Assets B.V., Erfinder: C. Wehrli.
- ↑ a b Making Cosmetics®, Avobenzone. In: makingcosmetics.com. Archiviert vom am 1. August 2015; abgerufen am 29. Juli 2015.
- ↑ a b G. J. Mturi, B. S. Martincigh: Photostability of the sunscreening agent 4-tert-butyl-4-methoxydibenzoylmethane (avobenzone) in solvents of different polarity and proticity. In: J. Photochem. Photobiol.: Chemistry. Band 200, 2008, S. 410–420, doi:10.1016/j.jphotochem.2008.09.007 (englisch).
- ↑ C. Paris, V. Lhiaubet-Vallet, O. Jiménez, C. Trullas, M. Angel Miranda: A Blocked Diketo Form of Avobenzone: Photostability, Photosensitizing Properties and Triplet Quenching by a Triazine-derived UVB-filter. In: Photochem. Photobiol. Band 85, Nr. 1, 2009, S. 178–184, doi:10.1111/j.1751-1097.2008.00414.x (englisch).
- ↑ J. J. Vallejo, M. Mesa, C. Gallardo: Evaluation of the avobenzone photostability in solvents used in cosmetic formulations
- ↑ S. Afonso u. a.: Photodegradation of avobenzone: Stabilization effect of antioxidants. In: J. Photoche. Photobiol.: Biology. Band 140, 2014, S. 36–40, doi:10.1016/j.photobiol.2014.07.004 (englisch).
- ↑ J. Yang, C. D. Wiley, D. A. Godwin, L. A. Felton: Influence of hydroxypropyl-
β -cyclodextrin on transdermal penetration and photostability of avobenzone. In: Eur. J. Pharm. Biopharm. Band 69, Nr. 2, 2008, S. 605–612, doi:10.1016/ejpb.2007.12.015 (englisch). - ↑ M. S. Reisch: After More Than A Decade, FDA Still Won’t Allow New Sunscreens. In: Chemical & Engineering News. Band 93, Nr. 20, 2015, S. 10–15 (acs.org).
- ↑ N. A. Shaath: SPF Boosters & Photostability of Ultraviolet Filters. HAPPI, Oktober 2007.
- ↑ U. Nguyen, D. Schlossman: Stability Study of Avobenzone with Inorganic Sunscreens. ( vom 7. Februar 2012 im Internet Archive) Kobo Products, Inc., (PDF-Datei).
- ↑ G. Zhang, J. Lu, M. Sabat, C. L. Fraser: Polymorphism and Reversible Mechanochromic Luminescence for Solid-State Difluoroboron Avobenzone. In: J. Am. Chem. Soc. Band 132, Nr. 7, 2010, S. 2160–2162, doi:10.1021/ja9097719 (englisch).
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): 1-[4-(1,1-dimethylethyl)phenyl]-3-(4-methoxyphenyl)propane-1,3-dione, abgerufen am 28. November 2023.