Brodifacoum
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
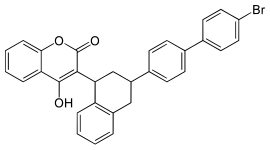
| |||||||||||||||||||
| Struktur ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Brodifacoum | ||||||||||||||||||
| Andere Namen |
3-[3-(4′-Brom-1,1′-biphenyl-4-yl)-1,2,3,4-tetrahydro-1-naphthyl]-4-hydroxycumarin | ||||||||||||||||||
| Summenformel | C31H23BrO3 | ||||||||||||||||||
| Kurzbeschreibung |
nahezu weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 523,4 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,42 g·cm−3 (25 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (0,24 mg·l−1)[2], schwach löslich in Ethanol und Benzol, löslich in Aceton und Chloroform[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Brodifacoum ist eine synthetisch hergestellte, hochgiftige chemische Verbindung aus der Gruppe der 4-Hydroxycumarine. Es handelt sich um ein creme- bis beigefarbenes lipophiles, in Wasser praktisch unlösliches, geruchloses Pulver. Brodifacoum wird als Rodentizid (Nagetiergift) eingesetzt.
Synthese
[Bearbeiten | Quelltext bearbeiten]Eine kommerzielle Herstellung verläuft über eine siebenstufige Synthesesequenz.[5][6] Im ersten Schritt wird Phenylessigsäurechlorid mit 4-Brombiphenyl in einer Friedel-Crafts-Acylierung umgesetzt. Das resultierende Keton wird zunächst mittels Natriumborhydrid zum Alkohol reduziert, der dann durch Phosphortribromid zur Bromverbindung nucleophil substituiert wird. Der vierte Syntheseschritt enthält eine Verknüpfung mit dem Natriumsalz des Malonsäurediethylesters, deren Produkt in Gegenwart von Polyphosphorsäure zu einem 3,4-Dihydro-2H-naphthalen-1-on-Zwischenprodukt zyklisiert wird. Eine zweite Reduktion mittels Natriumborhydrid ergibt ein 1,2,3,4-Tetrahydronaphthalen-1-ol-Derivat, das im letzten Syntheseschritt mit 4-Hydroxychromen-2-on zur Zielverbindung umgesetzt wird. Die Synthesesequenz ergibt ein Isomerengemisch.

Eine Synthese reiner Enantiomere ist wegen der geringen Wirksamkeitsunterschiede der Stereoisomere kommerziell unattraktiv. Laborsynthesen der einzelnen Isomere verlaufen unter Einsatz stereoisomerer Edukte und Zwischenprodukte.[7][8]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Stereochemie
[Bearbeiten | Quelltext bearbeiten]Brodifacoum ist eine chirale Verbindung, die zwei asymmetrisch substituierte Kohlenstoffatome enthält. Es ergeben sich somit vier Stereoisomere, wobei die (1S,3S)- und (1R,3R)-Isomere sowie die (1S,3R)- und (1R,3S)-Isomere entsprechende Enantiomerenpaare bilden. Die Schmelzpunkte betragen für das (1R,3S)- ,(1S,3R)-Isomerenpaar 227 °C bzw. für das (1R,3R)-, (1S,3S)-Isomerenpaar 224 °C.[7][9]

Das Racemat aus (1S,3S)- und (1R,3R)-Form ist diastereomer zu dem Racemat aus (1S,3S)- und (1R,3R)-Form. Die (racemischen) Diastereomere können anhand ihrer 1H- und 13C-NMR-Spektren unterschieden werden.[10] Brodifacoum liegt kommerziell als Gemisch von vier stereoisomeren Molekülen vor, die sich in ihren physiologischen Wirkungen unterscheiden. Auch bestimmte physikalische und chemische Eigenschaften der vier Stereoisomere sind unterschiedlich.
Durch geeignete Synthesestrategien („Asymmetrische Synthese“[7]) oder Trennverfahren (Racematspaltung[11]) lassen sich die einzelnen Stereoisomere gezielt rein herstellen oder isolieren.
Wirkung
[Bearbeiten | Quelltext bearbeiten]Für Vögel und Säugetiere wie auch den Menschen ist Brodifacoum sehr giftig, für Fische ist es noch toxischer. Die Aufnahme kann sowohl über den Verdauungstrakt (oral) als auch über die Haut oder die Atemwege geschehen.
Aufgrund der Strukturähnlichkeit von Cumarinen zu Vitamin K1 bewirken diese eine kompetitive Hemmung von Enzymen, die bei der Bildung des Gerinnungsfaktors Prothrombin des Blutes beteiligt sind. Somit heben sie indirekt die natürliche Gerinnungsfähigkeit des Blutes auf (indirektes Antikoagulans) und schädigen Blutgefäße (Leber). Dadurch tritt Blutflüssigkeit durch Schleimhäute, Körperhöhlen und innere Organe aus, was ein Verbluten des Opfers bewirkt. Entsprechend sind die allgemein für Antikoagulantien typischen Vergiftungssymptome Haut- und Schleimhautblutungen und in schweren Fällen Blut im Stuhl und Urin. Nach der Aufnahme einer tödlichen Dosis tritt der Tod nicht sofort, sondern erst nach vier bis fünf Tagen (bei Ratten) durch Entkräftung infolge des Blut- und Flüssigkeitsverlustes (Dehydratation) ein.
Toxizität
[Bearbeiten | Quelltext bearbeiten]Brodifacoum ist nach der EG-Verordnung Nr. 1272/2008 bzw. der TRGS 905 als fruchtschädigender Stoff der Kategorie 1B eingestuft.[12] Die erlaubte Tagesdosis (ADI) für den Menschen liegt bei 0,0000005 mg/kg/Tag (= 0,5 ng/kg/Tag) der NOAEL-Wert bei 0,001 mg/kg/Tag.[13]
Bei verschiedenen Säugetieren wurden für das Isomerengemisch folgende mittlere letale Konzentrationen (LD50) ermittelt:[1]
- Ratten (oral): 0,27 – 0,3 mg/kg
- Mäuse (oral): 0,4 mg/kg
- Kaninchen (oral): 0,3 mg/kg
- Meerschweinchen (oral): 0,28 mg/kg
- Katzen (oral): 0,25 mg/kg[1][14] – 25 mg/kg[15][16][17][18]
- Hunde (oral): 0,25 mg/kg
LD50-Werte für verschiedene Vögel:
- zwischen etwa 1 mg/kg und 20 mg/kg[19]
LC50 bei Fischen:
- Forelle (dem Stoff über 96 Stunden ausgesetzt): 0,051 mg/Liter.[20]
Für die einzelnen Stereoisomeren wurden an der Maus die folgenden LD50-Werte bestimmt:[7]
- (1R,3R)-Isomer: 0,5 – 0,8 mg/kg
- (1S,3S)-Isomer: 0,4 – 0,9 mg/kg
- (1S,3R)-Isomer: 0,4 – 0,9 mg/kg
- (1R,3S)-Isomer: 0,5 – 0,8 mg/kg
Die Wirksamkeit der verschiedenen Stereoisomere kann somit annähernd als gleich angesehen werden.
Gegenmaßnahmen
[Bearbeiten | Quelltext bearbeiten]Phyllochinon (Vitamin K1) wirkt – intramuskulär oder oral verabreicht – bei Cumarinen als Antidot.
Als Sofortmaßnahme bei oraler Aufnahme: Herbeiführen von Erbrechen. Eventuell kann Bluttransfusion erforderlich sein, um dem Blutverlust entgegenzuwirken.
Nutzung
[Bearbeiten | Quelltext bearbeiten]
Einsatz als Rodentizid
[Bearbeiten | Quelltext bearbeiten]Brodifacoum ist eines der bislang potentesten verfügbaren Rodentizide („Rattengift“)[21] und findet als solches weit verbreitete Anwendung zur Vergiftung von Nagetieren, hauptsächlich Ratten und Mäusen, aber auch Kaninchen und Opossums, wobei besonders für Raubtiere wie z. B. Katzen die Gefahr von Sekundärvergiftungen durch vergiftete Tierleichen besteht: Schon der Verzehr eines einzigen vergifteten Tieres kann tödlich sein.
Brodifacoum kommt als Wirkstoff in Fraßködern mit einem Gewichtsanteil von 0,005 % zum Einsatz[22] und wirkt als sogenanntes Antikoagulans der zweiten Generation („Super-Warfarin“) schon in Einmaldosis tödlich, tötet also auch Tiere mit einer Resistenz gegen Antikoagulantien der ersten Generation (namentlich Warfarin).
Der verzögerte Tod der Tiere bei diesen Mitteln ist dabei eine erwünschte Eigenschaft: Da keine Vorwarnung von Artgenossen stattfindet, sind sie damit auch bei sozial intelligenten Tieren wie z. B. Ratten effektiv, die bei sofort wirksamen Substanzen aufgrund ihrer sozialen Intelligenz schnell von ihren Artgenossen lernen, das ausgelegte Gift zu meiden. Die langsame Schwächung der Tiere bewirkt außerdem, dass sie kaum mehr Nahrung aufnehmen und schließlich mit praktisch leerem Magendarmtrakt sterben, was zur Folge hat, dass die Kadaver bei der Zersetzung weniger Gestank entwickeln. Eine Legende dagegen ist es, dass so vergiftete Nager auf der Suche nach Wasser menschliche Behausungen verlassen und im Freien sterben würden.
Brodifacoum wurde benutzt, um die Insel Südgeorgien von Ratten zu befreien, die dort von Menschen eingeführt wurden.[23]
Ähnliche Anwendung fand Brodifacoum auf der zu Australien gehörigen Lord-Howe-Insel, wo seit einem Schiffsunglück 1918 eingeschleppte Ratten mehrere endemische Tierarten ausgerottet hatten.[24]
Modifikation illegaler Drogen
[Bearbeiten | Quelltext bearbeiten]2018 veröffentlichte ein wissenschaftlicher Artikel im New England Journal of Medicine eine Fallserie von Drogenkonsumenten, die an einer schwer beherrschbaren Blutungsneigung litten. Alle Konsumenten hatten synthetische Cannabinoide eingenommen, die mit Brodifacoum sowie anderen Superwarfarinen kontaminiert waren. Die meisten Patienten überlebten, allerdings nur durch massive Gegenmaßnahmen mit Plasma-Infusionen und Vitamin-K-Gabe. Als Ursache der Kontamination wird angegeben, dass Hersteller der synthetischen Cannabinoide versuchen, durch zusätzliche Substanzen die Wirksamkeit oder das Wirkprofil zu beeinflussen. Aufgrund der leichten Verfügbarkeit und der hohen Gefährlichkeit wird die Verwendung von Brodifacoum auch von Sicherheitsbehörden und dem Centers for Disease Control and Prevention (CDC) kritisch beobachtet, um sein Potential als Mordgift zu bewerten.[25]
Zulassung
[Bearbeiten | Quelltext bearbeiten]Als Biozidprodukt
[Bearbeiten | Quelltext bearbeiten]Gemäß europäischer Gesetzgebung (Richtlinie 98/8/EG über das Inverkehrbringen von Biozid-Produkten)[26] und mit Beschluss vom 9. Februar 2010[27] liegt ein Entscheid vor, den Wirkstoff Brodifacoum in die entsprechende Liste (Anhang I/IA der Richtlinie 98/8/EG) für die Produktart 14 (Rodentizide) aufzunehmen. Die Abgabe von Biozidprodukte, die den Wirkstoff Brodifacoum enthalten, ist somit in der EU (die Schweiz hat diese Bestimmung übernommen) weiterhin erlaubt. Diese Bewilligung wurde jedoch an gewisse Auflagen geknüpft:
- Die nominale Konzentration des Wirkstoffs in den Produkten darf 50 mg/kg nicht übersteigen und es dürfen nur gebrauchsfertige Produkte zugelassen werden. Die Produkte dürfen nicht als Haftgift verwendet werden.
- Zur Risikominderung gegenüber Menschen, Nicht-Zieltieren und Umwelt sind geeignete Maßnahmen umzusetzen. So die Beschränkung auf die Anwendung durch Fachpersonal, die Festlegung einer Packungshöchstgröße und die Verpflichtung zur Verwendung zugriffsgesicherter, stabiler Köderboxen.
- Die Bewilligung wird vorerst befristet bis 31. Januar 2017, eine Verlängerung dieser Frist ist an eine erneute Risikobeurteilung geknüpft.
Als Pflanzenschutzmittel
[Bearbeiten | Quelltext bearbeiten]Gemäß europäischer Gesetzgebung (Richtlinie 91/414/EWG vom 15. Juli 1991 über das Inverkehrbringen von Pflanzenschutzmitteln)[28] und mit Beschluss vom 21. Juni 2007 der EU-Kommission[29] wurde entschieden, den Wirkstoff Brodifacoum nicht in den Anhang I der Richtlinie 91/414/EWG (Positivliste der in Pflanzenschutzmitteln zulässigen Wirkstoffe) aufzunehmen. Die Abgabe von Pflanzenschutzmitteln mit dem Wirkstoff Brodifacoum ist in der EU seit 2011 nicht mehr erlaubt.
In der Schweiz ist der Wirkstoff Brodifacoum gemäß Änderung der Pflanzenschutzverordnung[30] ab 15. Mai 2012 nicht mehr zugelassen.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Der Stoff ist eng verwandt mit dem für gleiche Zwecke genutzten, etwas weniger giftigen Bromadiolon.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c WHO/FAO Data Sheet on Pesticides (PDS) für Brodifacoum ( vom 11. April 2015 im Internet Archive)
- ↑ a b c d e Eintrag zu Brodifacoum in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-1 – 3-553.
- ↑ Eintrag zu 4-hydroxy-3-(3-(4′-bromo-4-biphenylyl)-1,2,3,4-tetrahydro-1-naphthyl)coumarin im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ R. S. Shadbolt, D. R. Woodward, P. J. Birchwood: Synthesis of Some Tetrahydronaphthyl- and Flavanyl-coumarins. In: J. Chem. Soc. Perkin Trans. I, 1976, S. 1190–1195, doi:10.1039/A607269K.
- ↑ R. T. Hadler, R. S. Shadbolt: Ger. Patent 2424806, 1975; US-Patent 3957824, 1976; US-Patent 4035505, 1977.
- ↑ a b c d P. S. van Heerden, B. C. B. Bezuidenhoudt, D. Ferreira: Efficient Asymmetric Synthesis of the Four Diastereomers of Diphenacoum and Brodifacoum. In: Tetrahedron. 53, 1997, S. 6045–6056, doi:10.1016/S0040-4020(97)00254-8.
- ↑ J.-C. Jung, O.-S. Park: Synthesic Approaches and Biological Activities of 4-Hydroxycoumarin Derivatives. In: Molecules. 14, 2009, S. 4790–4803, doi:10.3390/molecules14114790.
- ↑ P. S. van Heerden, B. C. B. Bezuidenhoudt, D. Ferreira: Improved synthesis for the rodenticides, diphenacoum and brodifacoum. In: J. Chem. Soc. Perkin Trans. 1, 1997, S. 1141–1146, doi:10.1039/A607269K.
- ↑ J. R. Cort, H. Cho: 1H and 13C NMR chemical shift assignments and conformational analysis for the two diastereomers of the vitamin K epoxide reductase inhibitor brodifacoum. In: Magn. Reson. Chem. 47, 2009, S. 897–901, doi:10.1002/mrc.2475.
- ↑ V. V. Shkarenda, P. V. Kuznetsov: Current state of the liquid column chromatography of coumarins. In: Chemistry of Natural Compounds. 29, 1993, S. 137–150, doi:10.1007/BF00630102.
- ↑ BG RCI Merkblatt M039 Fruchtschädigende Stoffe - Informationen für Mitarbeiter und betriebliche Führungskräfte, Ausgabe 8/2020, Jedermann-Verlag GmbH Heidelberg, ISBN 978-3-86825-040-4, BG RCI Downloadcenter.
- ↑ WHO Specifications and Evaluations for Public Health Pesticides: Brodifacoum. (PDF; 151 kB) WHO, S. 19, abgerufen am 10. Juni 2017 (englisch).
- ↑ Poisons Information Monograph (PIM) für Brodifacoum, abgerufen am 9. Dezember 2014.
- ↑ D. Kaukeinen: Experimental rodenticide (Talon) passes lab tests; moving to field trials in pest control industry. In: Pest Control. v. 47 (1), Jan 1979, S. 19–21, 46.
- ↑ Brodifacoum (Talon, Havoc) – Chemical Profile 1/85 auf cornell.edu
- ↑ Selleys: MSDS Data Sheet for Talon Rat and Mouse Killer ( vom 14. September 2009 im Internet Archive)
- ↑ Elaine C. Murphy, B. Kay Clapperton, Philip M. F. Bradfield, Hazel J. Speed: Brodifacoum residues in target and non-target animals following large-scale poison operations in New Zealand podocarp-hardwood forests. In: New Zealand Journal of Zoology. 25(4), 01/1998, S. 307–314. doi:10.1080/03014223.1998.9518160
- ↑ Health and Safety Guide (HSG) für Brodifacoum, abgerufen am 1. Dezember 2014.
- ↑ Sicherheitsdatenblatt AMB-Vertriebs GmbH. ( vom 14. Juli 2010 im Internet Archive) (PDF-Datei; 150 kB).
- ↑ Pelz, H.-J.; Freise, J.: Antikoagulantien-Resistenz bei kommensalen Nagern in Mitt. Julius Kühn-Inst. 421 (2009):Wirbeltierforschung in der Kulturlandschaft - Grundlagen und Anwendung, Zur Verabschiedung von Dr. Hans-Joachim Pelz in den Ruhestand, S. 68–75, Abstract und pdf.
- ↑ Eintrag zu Brodifacoum. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Juni 2014.
- ↑ Matt Ridley: The success of a bold bid to rid a subantarctic island of rats and deer
- ↑ Robert Wheeler, David Priddel, Terence O’Dwyer, Nicholas Carlile, Dean Portelli: Evaluating the susceptibility of invasive black rats (Rattus rattus) and house mice (Mus musculus) to brodifacoum as a prelude to rodent eradication on Lord Howe Island. In: Biological Invasions. Band 21, Nr. 3, März 2019, S. 833–845, doi:10.1007/s10530-018-1863-4.
- ↑ Amar H. Kelkar, Nichole A. Smith, Annia Martial, Harsha Moole, Michael D. Tarantino: An Outbreak of Synthetic Cannabinoid–Associated Coagulopathy in Illinois. In: New England Journal of Medicine. Band 379, Nr. 13, 27. September 2018, S. 1216–1223, doi:10.1056/NEJMoa1807652, PMID 30280655.
- ↑ Richtlinie 98/8/EG vom 16. Februar 1998 über das Inverkehrbringen von Biozid-Produkten. In: Amtsblatt der Europäischen Gemeinschaften. L, Nr. 123, 24. April 1998, S. 1–63.
- ↑ Richtlinie 2010/10/EU vom 9. Februar 2010 – Beschluss zur Änderung der Richtlinie 98/8/EG zwecks Aufnahme von Brodifacoum in Anhang I. In: Amtsblatt der Europäischen Gemeinschaften. L, Nr. 37, 10. Februar 2010, S. 44–46.
- ↑ Richtlinie 91/414/EWG vom 15. Juli 1991 über das Inverkehrbringen von Pflanzenschutzmitteln. ABl. L 230, 19. August 1991, S. 1–32.
- ↑ Entscheid vom 21. Juni 2007 (2007/442/EG) über die Nichtaufnahme bestimmter Wirkstoffe in Anhang I und Widerruf der Zulassungen für Pflanzenschutzmittel. In: Amtsblatt der Europäischen Gemeinschaften. L, Nr. 166, 28. Juni 2007, S. 16–23.
- ↑ CH: Änderung Pflanzenschutzmittelverordnung (PDF-Datei; 484 kB). SR 916.161 – Änderung vom 21. April 2011.
- Giftiger Stoff bei Verschlucken
- Giftiger Stoff bei Hautkontakt
- Giftiger Stoff bei Einatmen
- Stoff mit reproduktionstoxischer Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Antikoagulans
- Rodentizid
- Brombenzol
- Cumarin
- Enol
- Tetrahydronaphthalin
- Biphenyl
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 30


