Koordinationszahl
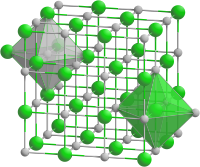
Als Koordinationszahl (KZ) bezeichnet man die Anzahl der nächsten Nachbarn einer Struktureinheit (Atom, Ion, Molekül) in einem Kristall (z. B. Ionenkristall, Metallgitter) bzw. die Anzahl der direkt an ein Zentralatom gebundenen Atome in einem Komplex. Eine Kristallstruktur wird durch die Angabe der Position ihrer Bausteine, d. h. durch deren Koordination in der Elementarzelle, beschrieben.
Am häufigsten treten die Koordinationszahlen 4 und 6 auf, seltener auch 2, 3, 8 und 12, bei Komplexen manchmal auch andere Werte. Die Koordinationszahl hängt unter anderem vom Radienverhältnis der Ionen (im Ionenkristall) bzw. von den Bindungseigenschaften (in Komplexen) ab. In Kristallen nimmt die Koordinationszahl meist mit dem Druck zu, z. B. beim Übergang von Graphit (KZ 3) zu Diamant (KZ 4).
Die Angabe der Koordinationszahl in Kristallgittern erfolgt in eckigen Klammern. Als Beispiel sei Kochsalz genannt: Na[6] Cl[6], was einer rechtwinkligen Gitterstruktur entspricht. Jedes Natriumion besitzt 6 Nachbar-Chloridionen und ebenso jedes Chloridion 6 Nachbar-Natriumionen, als Koordinationspolyeder ergibt sich in beiden Fällen ein Oktaeder.
In bestimmten Kristallstrukturen kann dieselbe Struktureinheit auch auf Positionen mit unterschiedlichen Koordinationszahlen vorkommen.
Koordinationszahlen in Komplexen
[Bearbeiten | Quelltext bearbeiten]Die Koordinationszahl ist eines der wichtigsten Strukturmerkmale von Komplexen und bestimmt die möglichen Koordinationspolyeder, d. h. die geometrische Anordnung der Donoratome um das Zentralatom bzw. -ion. Für Komplexe von Übergangsmetallen sind Koordinationszahlen von 2 bis 9 beobachtbar, während in Lanthanoid- und Actinoidkomplexen auch Koordinationszahlen bis zu 12 auftreten. Am häufigsten sind die Koordinationszahlen 6 und 4 vertreten. Analog zu Festkörperstrukturen nimmt die Koordinationszahl in der Regel mit zunehmender Größe des Zentralatoms bzw. -ions und abnehmender Größe der Liganden zu.[1]
| Koordinationszahl | Koordinationsgeometrie | Beispielverbindungen |
|---|---|---|
| 2 | linear, gewinkelt | |
| 3 | trigonal-planar, pyramidal, T-förmig | |
| 4 | tetraedrisch, quadratisch-planar | |
| 5 | trigonal-bipyramidal, quadratisch-pyramidal | |
| 6 | oktaedrisch, trigonal-prismatisch | |
| 7 | pentagonal-bipyramidal, überkappt oktaedrisch, überkappt trigonal-prismatisch | [V(CN)7]4-, ZrCl(PhCOCHCOPh)3, [Mo(CNMe)7][BF4]2 |
| 8 | dodekaedrisch, quadratisch antiprismatisch, kubisch, hexagonal-bipyramidal | Cd2[Mo(CN)8], K4[Mo(CN)8]⋅3 H2O, Cs3[Mo(CN)8] |
| 9 | dreifach überkappt trigonal-prismatisch | [ReH9]2- |
| 12 | ikosaedrisch, kuboktaedrisch | [Ce(NO3)6]3-/2- |
Beispiele
[Bearbeiten | Quelltext bearbeiten]In der folgenden Tabelle[2] sind die Koordinationszahlen einiger Gittertypen dargestellt.
| Gitterstruktur | Koordinationszahl |
|---|---|
| einfach kubisch (sc) | 6 |
| kubisch flächenzentriert (fcc) | 12 |
| kubisch raumzentriert (bcc) | 8 |
| hexagonal dichte Kugelpackung (hcp) | 12 |
| Diamantstruktur | 4 |
Literatur
[Bearbeiten | Quelltext bearbeiten]- R. Hoppe: Die Koordinationszahl – ein „anorganisches Chamäleon“. In: Angewandte Chemie, 82(1), 1970, S. 7–16, doi:10.1002/ange.19700820103
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Christoph Janiak, Hans-Jürgen Meyer, Dietrich Gudat, Carola Schulzke: Moderne Anorganische Chemie. 6. Auflage. De Gruyter Verlag, Berlin 2023, ISBN 978-3-11-079007-8, S. 444–453.
- ↑ Harald Ibach, Hans Lüth: Festkörperphysik. 7. Auflage. Springer Verlag, Berlin 2009, ISBN 978-3-540-85794-5, S. 31–35.