Trifluoroacetata acido
| Trifluoroetanata acido | ||||

| ||||
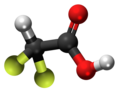
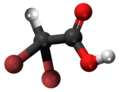
| Kemia strukturo de la Trifluoracetata acido | ||||

| ||||
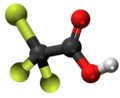
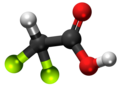
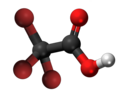
| 3D Kemia strukturo de la Trifluoracetata acido | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 76-05-1 | |||
| ChemSpider kodo | 10239201 | |||
| PubChem-kodo | 6422 | |||
| Fizikaj proprecoj | ||||
| Aspekto | Senkolora aŭ palflava likvaĵo | |||
| Molmaso | 114.02 g mol−1 | |||
| Denseco | 1489 g/cm3 | |||
| Fandopunkto | −15.4 °C (4.3 ℉; 257.8 K) | |||
| Bolpunkto | 72.4 °C (162.3 ℉; 345.5 K) | |||
| Acideco (pKa) | 0,23 | |||
| Merck Index |
| |||
| Sekurecaj Indikoj | ||||
| Risko | R20 R35 R52/53 | |||
| Sekureco | S9 S26 S27 S28 S45 S61 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝa substanco | |||
| GHS Deklaroj pri damaĝoj | H290, H314, H331, H412 | |||
| GHS Deklaroj pri antaŭgardoj | P260, P273, P280, P303+361+353, P305+351+338, P312 | |||
Trifluoracetata acido, TFA, hidrogena trifluoracetato[1] aŭ F3C-COOH estas organika kombinaĵo de acetata acido kaj fluoro, senkolora likvaĵo kun akra odoro simila al vinagro, sed pli forta laŭ acideco. TFA estas analoga al acetata acido kie tri hidrogenatomoj estas anstataŭata de tri fluoratomoj. La acideco de la TFA estas proksimume 34 mil fojojn pli forta ol tiu de acetata acido pro la elektronegativeco de la trifluorometila grupo. TFA estas vaste uzata en organika kemio por multaj celoj.
Sintezo
[redakti | redakti fonton]- Industria preparado de trifluoracetata acido rezultas el interagado de acetila klorido kaj fluorida acido, sekvata de hidrolizo:
Uzoj
[redakti | redakti fonton]TFA estas antaŭulo al pluraj aliaj fluorigitaj kombinaĵoj tia kia trifluoracetata anhidrido[2] kaj 2,2,2-trifluoroetanolo.[3] Ĝi estas reakcianto uzata en organika sintezo pro la kombinado de konvenaj proprecoj tiel kiel: volatileco, solvebleco en organikaj solvaĵoj kaj ĝia forto kiel acido. TFA same estas malpli oksidiga ol sulfata acido, tamen, pli facile disponebla en anhidra formo ol multaj aliaj acidoj. Alia komplikaĵo al ĝia uzo estas ke TFA formas azeotropon kun akvo (bolpunkto 105 °C).
TFA estas populare uzata kiel forta acido en peptida sintezo kaj aliaj organikaj sintezoj por forigo de la protekta grupo t-butokso-karbonila.
En malaltaj koncentriĝoj, TFA uzatas kiel parigagento en likva kromatografio (Altefika Likva kromatografio aŭ angla mallonglitero HPLC) de organikaj kombinaĵoj, aparte de peptidoj kaj etaj proteinoj. TFA estas multeuza solvanto por Spektroskopio per magneta nuklea resonanco (por materialoj acidostabilaj). Ĝi same uzatas kiel kalibranto en masa spektrometrio. TFA estas koroda kaj toksa acido, tamen, la danĝero ne estas asociita al la fluorida acido, ĉar la karbona-fluora ligaĵo ne estas malstabila.
Komponaĵoj
[redakti | redakti fonton]YouTube
[redakti | redakti fonton]Literaturo
[redakti | redakti fonton]- Sigma Aldrich[rompita ligilo]
- Science Direct
- TCI America
- ACS Publications
- Avantor
- Chemical Book
Halogenidaj derivaĵoj de acetata acido
[redakti | redakti fonton]
| ||||||