Trifluoruro de cloro
| trifluoruro de cloro | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Fórmula molecular | ClF3 | |
| Identificadores | ||
| Número CAS | 7790-91-2[1] | |
| Propiedades físicas | ||
| Densidad | 4000 kg/m³; 4 g/cm³ | |
| Masa molar | 9245 g/mol | |
| Punto de fusión | −76,34 °C (197 K) | |
| Punto de ebullición | 11,75 °C (285 K) | |
| Presión de vapor | 175 kPa | |
| Viscosidad |
91,82 | |
| Termoquímica | ||
| −158,87 kJ/mol | ||
| S0gas, 1 bar | 281,59 J K−1mol−1[3] J·mol–1·K | |
| Peligrosidad | ||
| NFPA 704 |
0
4
3
W+OX
| |
| Frases R | R8, R14, R39/26/27/28, R35, R45, R46, R60, R61 | |
| Frases S | S1/2, S17, S30, S38, S45, S53, S60, S61 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El trifluoruro de cloro es un compuesto interhalógeno de fórmula ClF3. Es un gas incoloro y tóxico, corrosivo y extremadamente reactivo que se condensa en un líquido de color amarillo pálido-verdoso, la forma en que más a menudo se venden (a presión a temperatura ambiente). El compuesto se emplea principalmente como componente de combustibles para cohetes, en las operaciones industriales de limpieza y decapado en la industria de semiconductores,[2][3] en el procesamiento de combustible nuclear de reactores,[4] y otras operaciones industriales.[5]
Preparación, estructura y propiedades
[editar]La primera mención fue en 1930 por Ruff y Krug que lo preparó por fluoración de cloro; también se forma ClF y la mezcla se separa por destilación[6]
- 3 F2 + Cl2 → 2 ClF3
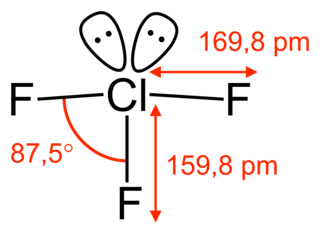
El ClF3 tiene aproximadamente forma de T, con un enlace corto (1,598 Å) y dos enlaces largos (1,698 Å).[7] Esta estructura coincide con la predicción de la teoría VSEPR, que predice pares de electrones que ocupan dos posiciones ecuatoriales de una bipirámide trigonal hipotética. Las alargadas Cl-Faxial enlaces son consistentes con la unión hipervalente.
El ClF3 puro es estable a 180 °C en recipientes de cuarzo, por encima de esta temperatura se descompone por un mecanismo de radicales libres a los elementos.
Reacciones
[editar]La reacción con varios metales da cloruros y fluoruros ; con fósforo produce tricloruro de fósforo (PCl3) y pentafluoruro de fósforo (PF5), y con azufre da dicloruro de azufre (SCl2) y tetrafluoruro de azufre (SF4). El ClF3 también reacciona de forma explosiva con el agua, oxida el agua para dar oxígeno o en cantidades controladas, difluoruro de oxígeno (OF2), así como fluoruro de hidrógeno y cloruro de hidrógeno. Los óxidos metálicos reaccionan para formar haluros de metal y oxígeno o difluoruro de oxígeno.
- ClF3 + 2H2O → 3HF + HCl + O2
- ClF3 + H2O → HF + HCl + OF2
El uso principal de ClF3 es producir hexafluoruro de uranio, UF6, como parte del procesamiento de combustible nuclear y el reprocesamiento, mediante la fluoración del metal de uranio:
- U + 3 ClF3 → UF6 + 3 ClF
Peligros
[editar]El ClF3 es un fuerte oxidante y agente de fluoración. Es extremadamente reactivo con la mayoría de los materiales, tanto inorgánicos como orgánicos, incluso vidrio y teflón, y provoca la combustión de muchos materiales no inflamables, sin ninguna fuente de ignición. Estas reacciones son a menudo violentas, y en algunos casos explosivas.
La característica de superar la capacidad oxidante del oxígeno conduce a una corrosividad extrema en contra de compuestos de óxido, que a menudo se consideran como incombustibles. En un accidente industrial, un derrame de 900 kg de trifluoruro de cloro, quemó una capa de 30 cm de cemento y 90 cm de la grava por debajo.[8] Cualquier equipo que entra en contacto con el trifluoruro de cloro debe ser cuidadosamente revisado y limpiado, ya que cualquier contaminación arde explosivamente al contacto. Además, solo los más poderosos agentes de extinción de incendios puede apagar un fuego de ClF3, y muchos otros medios de control/supresión de fuegos o bien son incapaces de suprimir esta oxidación o lo pueden agravar; hay casos donde el trifluoruro de cloro y sus gases han prendido arena, asbesto y otros materiales altamente ignífugos. Reacciona violentamente con compuestos base de agua, supresores, y se oxida en la ausencia de oxígeno atmosférico, lo que hace a los supresores de desplazamiento atmosférico tales como CO2 y halón completamente ineficaces. Hace arder el vidrio por contacto.[9]
La exposición a grandes cantidades de trifluoruro de cloro, como un líquido o como un gas, provoca que el tejido se encienda. La reacción de hidrólisis con agua es violenta y la exposición da como resultado una quemadura térmica. Los productos de hidrólisis son principalmente ácido fluorhídrico y ácido clorhídrico, que generalmente se liberan en forma de vapor debido a la naturaleza altamente exotérmica de la reacción. El ácido fluorhídrico es corrosivo para los tejidos humanos, se absorbe a través de la piel, ataca selectivamente hueso y afecta la función nerviosa, y causa el envenenamiento por flúor, a menudo fatal. El ácido clorhídrico tiene un peligro secundario para los organismos vivos, pero es varias veces más corrosivo para los materiales inorgánicos que el ácido fluorhídrico.
Aplicaciones
[editar]Aplicaciones militares
[editar]Bajo el nombre de código N-Stoff ("sustancia N"), el trifluoruro de cloro se investigó para aplicaciones militares en el Instituto Kaiser Wilhelm de la Alemania nazi desde un poco antes del inicio de la Segunda Guerra Mundial. Las pruebas se hicieron contra maquetas de las fortificaciones de la línea Maginot. Se encontró que era una efectiva arma combinada: incendiaria y gas venenoso. A partir de 1938 comenzó la construcción de una complejo de municiones en Falkenhagen, parte en búnkeres, parte subterráneo, de 31,76 km² que estaba destinada a producir 50 toneladas de N-stoff por mes, más gas sarín. Sin embargo, cuando fue capturado por el avance del Ejército Rojo en 1944, la fábrica había producido solo unas 30 a 50 toneladas, con un costo de más de 100 Reichsmark alemán por kilogramo. El N-stoff nunca fue utilizado en la guerra.
Comburente para cohetes
[editar]Se investigó la posibilidad de emplear trifluoruro como comburente almacenable de alto rendimiento en sistemas de propulsión con cohetes. Sin embargo, la dificultades y precauciones impidieron su uso. John D. Clark resume las dificultades:
"Es, por supuesto, extremadamente tóxico, pero es el menor problema. Es hipergólico con cada combustible conocido, y tan rápidamente que no ha sido medido retraso de la ignición. También es hipergólico con cosas tales como tela, madera, y los ingenieros de prueba, por no hablar de asbesto, arena y agua (con la cual reacciona explosivamente). Se puede contener en algunos de los metales estructurales comunes (acero, cobre, aluminio, etc.) a causa de la formación de una fina película de fluoruro de metal insoluble que protege la mayor parte del mismo, tal como la capa invisible de óxido de aluminio evita que se queme en la atmósfera. Sin embargo, si esta capa desaparece, y no tiene la oportunidad de volverse a formar, el operador se enfrenta con el problema de hacer frente a un incendio de metal-flúor. Para lidiar con esta situación, siempre he recomendado un buen par de zapatillas de correr".[10][11][12]
Industria de semiconductor
[editar]En la industria de los semiconductores, el trifluoruro de cloro se utiliza para limpiar cámaras de deposición química de vapor.[13] Tiene la ventaja de que puede ser utilizado para eliminar el material semiconductor de las paredes de la cámara sin tener que desmontar la cámara.[13] A diferencia de la mayoría de los productos químicos alternativos utilizados en este papel, no necesita ser activado por el uso de plasma ya que el calor de la cámara es suficiente para hacer que se descomponen y reaccionan con el material semiconductor.[13]
Referencias
[editar]- ↑ Número CAS
- ↑ Hitoshi Habuka, Takahiro Sukenobu, Hideyuki Koda, Takashi Takeuchi, and Masahiko Aihara (2004). «Silicon Etch Rate Using Chlorine Trifluoride». Journal of the Electrochemical Society 151 (11): G783-G787. doi:10.1149/1.1806391.
- ↑ United States Patent 5849092 "Process for chlorine trifluoride chamber cleaning"
- ↑ Board on Environmental Studies and Toxicology, (BEST) (2006). Acute Exposure Guideline Levels for Selected Airborne Chemicals: Volume 5 (citation at the National Academies Press). Washington D.C.: National Academies Press. p. 40. ISBN 0-309-10358-4.
- ↑ United States Patent 6034016 "Method for regenerating halogenated Lewis acid catalysts"
- ↑ Otto Ruff, H. Krug (1930). «Über ein neues Chlorfluorid-CIF3». Zeitschrift für anorganische und allgemeine Chemie 190 (1): 270-276. doi:10.1002/zaac.19301900127.
- ↑ Smith, D. F. (1953). "The Microwave Spectrum and Structure of Chlorine Trifluoride". The Journal of Chemical Physics 21 (4): 609–614. Bibcode 1953JChPh..21..609S. doi:10.1063/1.1698976
- ↑ Air Products https://web.archive.org/web/20060318221608/http://www.airproducts.com/nr/rdonlyres/8479ed55-2170-4651-a3d4-223b2957a9f3/0/safetygram39.pdf
- ↑ Pradyot Patnaik (2007). A comprehensive guide to the hazardous properties of chemical substances (3rd edición). Wiley-Interscience. p. 478. ISBN 0-471-71458-5.
- ↑ Clark, John D. (2001). Ignition!. UMI Books on Demand. ISBN 0-8135-0725-1.
- ↑ Clark, John D. (1972). Ignition! An Informal History of Liquid Rocket Propellants. Rutgers University Press. pp. 214. ISBN 0-8135-0725-1.
- ↑ ClF3/Hydrazine Archivado el 2 de febrero de 2007 en Wayback Machine. at the Encyclopedia Astronautica.
- ↑ a b c «In Situ Cleaning of CVD Chambers». Semiconductor International. 6 de enero de 1999. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).

