Heterogeenne katalüüs
Heterogeenne katalüüs (inglise keeles heterogeneous catalysis) on katalüüsi tüüp, kus katalüsaatori faas erineb reagentide omast. Heterogeense katalüüsi korral ei viita faas ainult tahkele, vedelale või gaasilisele olekule, vaid ka segunematutele vedelikele (näiteks õli ja vesi). Suur osa praktikas kasutatavaid heterogeenseid katalüsaatoreid on tahked, reagendid seevastu on sageli gaasid või vedelikud.[1] Heterogeenne katalüüs on oluline erinevates keemia- ja energiatööstuse valdkondades.
Heterogeense katalüüsi uurimise eest on Nobeli auhinna saanud Fritz Haber 1918., Carl Bosch 1931, Irving Langmuir 1932. ja Gerhard Ertl 2007. aastal.[2][3][4][5][6]
Heterogeense ja homogeense katalüüsi võrdlus
Homogeenne katalüüs erineb heterogeensest katalüüsist, kuna homogeense katalüüsi korral on katalüsaator ja reagendid samas faasis. Heterogeense katalüüsi üheks tähtsaks eeliseks on katalüsaatori kerge eraldatavus produktidest. Samuti on heterogeensed katalüsaatorid sageli stabiilsemad ja lagunevad palju aeglasemalt kui homogeensed katalüsaatorid. Heterogeenseid katalüsaatoreid on raske uurida, seega on nende mehhanismid sageli tundmatud.[7] Ensüümidel on nii heterogeensete kui ka homogeensete katalüsaatorite omadusi. Seetõttu käsitletakse ensüüme eraldiseisva kolmanda katalüsaatorite kategooriana.
Adsorptsioon
Adsorptsioon on heterogeenses katalüüsis tavaliselt esimene samm. Adsorptsiooniks nimetatakse gaasilise või lahustunud molekuli seondumist tahkise või vedeliku pinnal olevate aatomitega. Molekuli, mis seondub, nimetatakse adsorbaadiks ja pinda, millele ta kinnitub, nimetatakse adsorbendiks. Protsessi, kus adsorbaat seondub adsorbendile, nimetataksegi adsorptsiooniks. Vastupidist protsessi, kus adsorbaat vabaneb adsorbendilt, nimetatakse desorptsiooniks. Vaadeldes protsessi kui katalüsaatorikandurit, on katalüsaatoriks adsorbaat ja kanduriks adsorbent.
Adsorptsiooni tüübid
Heterogeense katalüüsi puhul eristatakse kahte adsorptsiooni tüüpi, kuigi paljud protsessid langevad ebamäärasesse vahemikku, mis jääb nende kahe vahele. Esimest tüüpi adsorptsiooni kutsutakse füüsikaliseks adsorptsiooniks, mis tekitab ainult väikeseid muutuseid adsorbaadi elektronstruktuurile. Tavaline energiakulu füüsikalise adsorptsiooni puhul on 2–10 kcal/mol. Teist tüüpi adsorptsiooni kutsutakse kemosorptsiooniks, mille juures muutub adsorbaadi struktuur tunduvalt, sageli sidemete lõhkumise tõttu. Energiakulu kemosorptsiooni juures jääb tavaliselt vahemikku 15–100 kcal/mol.
Füüsikalise adsorptsiooni puhul tõmbavad adsorbaati pinnakihi aatomite poole van der Waalsi jõudud (nõrgad jõud). Füüsikalist adsorptsiooni iseloomustava matemaatilise mudeli töötas välja Saksa-Ameerika füüsik Fritz London, et prognoosida energiakulusid mittepolaarsete molekulide puhul, mis alluvad tavapärasele füüsikalisele adsorptsioonile. Füüsikalise adsorptsiooni analüüsimine polaarsete ja iooniliste molekulide puhul on keerulisem.
Kemosorptsioon on adsorbaadi ja adsorbendi vahelise elektronide jagamise tulemus. Kemosorptsiooni kirjeldatakse traditsiooniliselt Lennard-Jonesi potentsiaali abil, mis kajastab erinevaid kemosorptsiooni viise, näiteks:
- molekulaarne adsorptsioon, kus adsorbaat jääb muutumatuks, näiteks alkeeni seondumine plaatina abil;
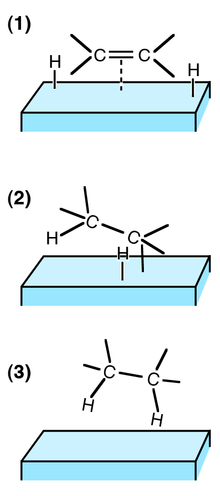
- dissotsiatsiooni adsorptsioon, kus üks või mitu sidet katkeb üheaegselt adsorptsiooni käigus. Siin sõltub adsorptsiooni kiirus dissotsiatsiooni barjäärist. Näiteks toimub see vesiniku seondumisel, kus H-H-side lõhutakse adsorptsioonil.[8]
Pinnareaktsioonid
Reaktsioon, kuhu on kaasatud katalüsaatorikandur, toimub tihti kas katalüsaatori või kandja pinnal. Pinnareaktsioonid võivad toimuda kolme mehhanismi abil.
- Langmuir-Hinshelwoodi mehhanism – kaks molekuli, A ja B, on mõlemad adsorbeerunud pinnale. Olles adsorbeerunud, saavad molekulid A ja B kokku, seonduvad ning uus molekul A-B desorbeerub.
- Rideal-Eley' mehhanism – üks kahest molekulist, A, adsorbeerub pinnale. Teine molekul B ei adsorbeeru, vaid leiab pinnale seondunud A, reageerib ja seondub A-ga, seejärel äsja moodustunud A-B desorbeerub.
- Eelkäija mehhanism – üks kahest molekulist, A, on adsorbeerunud pinnale. Teine molekul B põrkab pinnaga kokku, moodustades mobiilse eelkäija staadiumi. Seejärel põrkab molekul B kokku pinnal oleva A-ga, toimub reaktsioon, nad seonduvad ning uus molekul desorbeerub.
Kõiki pinnareaktsioone saab kirjeldada nende mehhanismide või nende kombinatsioonide abil. Lisaks võivad kõik kolm reaktsiooni toimuda ka vastupidi. Üldiselt on reaktsiooni tee pinnareaktsiooni korral järgmine – reagendid adsorbeeruvad pinnale, seejärel adsorbeeruvad korduva sidemete moodustumise ja lõhkumise tagajärjel pinnale intermediaadid, mis hävitatakse. Viimaks produtseeritakse lõppsaadus(ed), mis seejärel desorbeeruvad pinnalt.[8]
Põhimõte
Heterogeense katalüüsi korral difundeeruvad reagendid katalüsaatori pinnale ja adsorbeeruvad sellel, moodustades keemilisi sidemeid. Pärast reaktsiooni desorbeeruvad produktid pinnalt ja hajuvad laiali. Selle transportnähtuse ja pinnakeemia kui dispersiooni mõistmine on tähtis. Kui difusiooni kiirust mitte arvesse võtta, sõltuvad kõikvõimalikud reaktsioonid pindadel ainult kiiruskonstantidest ja reagendi kontsentratsioonist. Tahkete heterogeensete katalüsaatorite korral on katalüsaatori pindala oluline, kuna see määrab aktiivtsentrite kättesaadavuse. Pindala võib olla suur, näiteks on mõnedel mesopoorsetel ränidioksiidide molekulidel alasid, mille pindala on 1000 m2/g. Tavapärane lähenemine pindala maksimeerimiseks on kasutada katalüsaatorikandurit (materjal, mille ümber onkatalüsaatorid koondunud).
Heterogeense katalüüsi klassid
Enamus heterogeenseid katalüsaatoreid on tahked, kuid leidub palju variatsioone.
| Reageeriv faas | Näited | Kommentaarid |
|---|---|---|
| Tahke + gaas | Ammoniaagi süntees N2 + H2 raudkatalüsaatoril | Promootoriteks on K2O ja Al2O3 |
| Tahke + lahus | Rasvhapete hüdrogeenimine niklil | Kasutatakse margariini tootmisel |
| Segunematu vedelfaas | Propeeni hüdroformüülimine | Katalüsaator on vedelfaasis, reagendid ja produktid on peamiselt teistes faasides |
Näited
Heterogeense katalüüsi kasutamise kohta on mitmesuguseid näiteid, järgnevas tabelis keskendutakse suuremahulistele tööstusprotsessidele.[9]
| Protsess | Reagendid, produkt(id) | Katalüsaator | Kommentaar |
|---|---|---|---|
| Väävelhappe süntees (kontaktprotsess) | SO2 + O2, SO3 | Vanaadiumoksiid | SO3 hüdratsiooni käigus tekib H2SO4 |
| Ammoniaagi süntees (Haber-Boschi protsess) | N2 + H2, NH3 | Raudoksiidid alumiiniumil | Reaktsioonile kulub 1% maailma tööstuslikust energiatarvest |
| Lämmastikhappe süntees (Ostwaldi protsess) | NH3 + O2, HNO3 | Pt-Rh võre | Otseteed N2-st ei ole ökonoomsed |
| Vesiniku tootmine aurufaasis reformimisega | CH4 + H2O, H2 + CO2 | Nikkel või K2O | Otsitakse keskkonnasõbralikumat meetodit vee lõhustamisega |
| Etüleenoksiidi süntees | C2H4 + O2, C2H4O | Hõbe alumiiniumil paljude promootoritega | Keeruline rakendada teiste alkeenide jaoks |
| Vesiniktsüaniidi süntees (Andrussowi protsess) | NH3 + O2 + CH4, HCN | Pt-Rh | Sarnaselt muundab süsivesinikud nitriilideks ammoksüdatsioon |
| Alkeeni polümerisatsioon (Ziegleri-Natta polümerisatsioon) | propüleen, polüpropüleen | TiCl3 magneesiumkloriidil | On olemas palju variatsioone, ka homogeense katalüüsiga |
| Petrooleumi desulfureerimine (hüdrodesulfureerimine) | H2 + R2S (idealiseeritult kujutatud väävelorgaanilise ühendi ebapuhtus), RH+ H2S | Mo-Co alumiiniumil | Tekivad madala väävlisisaldusega süsivesinikud, väävel taastatakse Clausi protsessi abil |
Teised näited
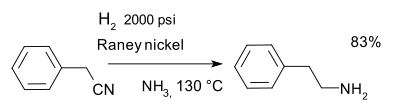
- Nitriili reduktsioon, näiteks fenetüülamiini sünteesil Raney' nikli ja ammoniaagiga.[10]
- Süsivesinike krakkimine, isomerisatsioon ja reformatsioon, et saada sihtotstarbelisi bensiinisegusid.
- Universaalseid katalüsaatoreid kasutatakse sageli sõidukites. Kolm põhilist reaktsiooni, mida katalüüsib universaalne katalüsaator:
- 1) Süsinikmonoksiidi oksüdeerimine süsinikdioksiidiks:
2CO(g) + O2(g) → 2CO2(g)
- 2) Lämmastikmonooksiidi redutseerimine tagasi lämmastikuks:
2NO(g) + 2CO(g) → N2(g) + 2CO2(g)
- 3) Süsivesinike oksüdatsioon veeks ja süsinikdioksiidiks:
2C6H6 + 15O2 → 12CO2 + 6H2O
- See protsess saab toimuda ükskõik millise süsivesinikuga, kuid kõige sagedamini kasutatakse seda bensiini ja diislikütuse jaoks.
- Asümmeetrilise heterogeense katalüüsiga saab toota enantiomeerselt rikastatud ühendeid, kasutades selleks kiraalseid heterogeenseid katalüsaatoreid.[11]
- Enamik heterogeensetest katalüsaatoritest põhinevad metallidel või metalloksiididel, kuigi mõnda reaktsiooni saab katalüüsida süsinikul põhineva ainega, näiteks oksüdatiivset dehüdrogeenimist[12] või selektiivset oksüdatsiooni:[13]
- etüülbenseen + ½O2 -> stüreen + H2O
- akroleiin + ½O2 -> akrüülhape
Viited
- ↑ ISBN 978-3-527-31824-7, Gadi Rothenberg, Catalysis: Concepts and green applications, Wiley-VCH: Weinheim. Heterogeense katalüüsi peamisteks etappideks on katalüsaatori adsorptsioon, pinnareaktsioon, lõppsaaduse produktsioon ning katalüsaatori desorptsioon.
- ↑ Swathi, R.S. and Sebastian, K.L. Molecular mechanism of heterogeneous catalysis. Resonance Vol. 13 Issue 6 (2008) p. 548–560.
- ↑ Fritz Haber, Nobel Lectures, Chemistry 1901–1921, Elsevier Publishing Company, Amsterdam, 1966
- ↑ Carl Bosch, Nobel Lectures, Chemistry 1922–1941, Elsevier Publishing Company, Amsterdam, 1966
- ↑ Irving Langmuir, Nobel Lectures, Chemistry 1922–1941, Elsevier Publishing Company, Amsterdam, 1966
- ↑ Gerhard Ertl, Les Prix Nobel. The Nobel Prizes 2007, Editor Karl Grandin, [Nobel Foundation], Stockholm, 2008
- ↑ G. O. Spessard and G. L. Miessler "Organometallic Chemistry", Prentice Hall, Upper Saddle River, NJ, 1997, pp. 249–251.
- ↑ 8,0 8,1 ISBN 978-0-471-30392-3, R. I. Masel, "Principles of Adsorption and Reaction on Solid Surfaces", Wiley Series in Chemical Engineering, Wiley-Interscience, New York, USA, 1996.
- ↑ doi:10.1002/0470862106.ia084, Zhen Ma, Francisco Zaera "Heterogeneous Catalysis by Metals" in Encyclopedia of Inorganic Chemistry, 2006, John Wiley.
- ↑ PDF, Organic Syntheses, Coll. Vol. 3, p.720 (1955); Vol. 23, p.71 (1943).
- ↑ Heitbaum, Glorius, Escher, Asymmetric heterogeneous catalysis, Angew. Chem. Int. Ed. 2006, 45, 4732.
- ↑ Bibcode:2008Sci...322...73Zdoi:10.1126/science.1161916PMID 18832641, Zhang, J.; Liu, X.; Blume, R.; Zhang, A.; Schlögl, R.; Su, D. S. (2008). "Surface-Modified Carbon Nanotubes Catalyze Oxidative Dehydrogenation of n-Butane". Science 322 (5898): 73–77.
- ↑ doi:10.1002/anie.201103340, Frank, B.; Blume, R.; Rinaldi, A.; Trunschke, A.; Schlögl, R. (2011). "Oxygen Insertion Catalysis by sp2 Carbon". Angew. Chem. Int. Ed. 50 (43): 10226–10230.