Estekatzaile
| Estekatzaile | |
|---|---|
| Mota | moiety (en) |
| Identifikatzaileak | |
| Gmelin | 52214 |
| MeSH | D008024 |
Kimikan estekatzailea edo ligandoa da koordinazio-konplexuen osatze-prozesuan, ioi edo molekula metaliko bati elektroi-pare bat ematen dion ioia edo molekula[1].
Estekatzaileak, espezie monoatomikoak edo poliatomikoak izan daitezke, lehenak, anioiak eta bigarrenak anioiak edo molekula polarrak izanik. Haluroak, (F-, Cl-, Br-, eta I-) lehen taldeari dagozkio, zianuro (CN-), isozianatoa (SCN-), amoniakoa (NH3), ura, aminak eta azido organikoak bigarren taldeari dagozkiolarik. Estekatzaile guztien berezitasun amankomuna, gutxienez elektroi bikote bat askerik izatea da eta zentzu horretan Lewis-en baseak dira[2].
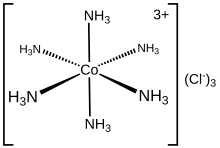
Estekatzaile-motak
[aldatu | aldatu iturburu kodea]Emateko moduan dituzten elektroi-bikoteen kopuruaren arabera, estekatzaileak hainbat taldetan sailka daitezke.
Hortz bakarreko estekatzaileak
[aldatu | aldatu iturburu kodea]Emateko elektroi-bikote bakarra duten estekatzaileei hortz bakarreko esaten zaie. Horrelakoak dira, amoniakoa, ura, haluro anioiak edo alkilo anioiak.
Hortz anitzeko estekatzaileak
[aldatu | aldatu iturburu kodea]Emateko elektroi-bikote bat baino gehiago dituzten estekatzaileei hortz anitzekoak esaten zaie; bi hortzekoak, hiru hortzekoak, lau hortzekoak, ... izan daitezke. Horrelakoak, fosfato anioiak (PO3-), karbonato anioiak (CO2-), oxalato anioiak (-OOCCOO-), etilendiamina eta bipiridina.
Hortz anitzeko estekatzaileek aukera dute elektroi-bikote horiek ioi metaliko bakarrarekin lotzekoa eta eraztun moduko egiturak eratzen dituzte: kelatoak

Hortz anitzeko estekatzaileen artean batzuk txikiegiak dira tamainaz aldi berean bi elektroi-bikote emateko, nahiz eta elektroiak emateko gaitasuna duten atomo bat baino gehiago izan. Horiek atomo baten edo beste baten bidez lotzen dira zirkunstantzien arabera. Horrelakoak dira tioisozianato (S=C=N-), nitrito (O=N-O-) eta isotiozianato (NC-S-) anioiak.
Estekatzaile-motak eta lotura-motaka[3]
[aldatu | aldatu iturburu kodea]Estekatzaile σ -emaileak eta π -emaileak
[aldatu | aldatu iturburu kodea]Estekatzaile oso elektronegatiboek, base sendoak, eta nukleoaren inguruan elektroi-dentsitate handia dute. Oxidazio-egoeran altuan dauden trantsizio-metalak egonkortzen dituzte batez ere. Metalak d orbitalak hutsik ditu eta estekatzaileak eskaintzen dion
Estekatzaile σ -emaileak
[aldatu | aldatu iturburu kodea]Trantsizio-seriaren oxidazio-egoerarik egonkorrena egonkortzen dute. Horrelakoak dira ura, amoniakoa eta aminak
Estekatzaile σ -emaileak eta π -hartzaileak
[aldatu | aldatu iturburu kodea]Hauen artean bada kasu berezi bat. Alegia,
Erreferentziak
[aldatu | aldatu iturburu kodea]- ↑ Estekatzaile. Zientzia eta teknologia hiztegi entziklopedikoa. Elhuyar, https://zthiztegia.elhuyar.eus/terminoa/eu/estekatzaile or..
- ↑ Basterretxea, Francisco; Zabala, Gorka; Mijangos, Fernando; Izurieta, Itziar; Etxebarria, Nestor & Martinez de Marigorta,, Edorta. (1996). Kimika orokorra. UEU, 405 or. ISBN 84-86967-71-6..
- ↑ Castillo Garcia, Oscar & Beobide Pacheco,, Garikoitz. Kimika ez-organiko aurreratua. EHU, 44-46 or. ISBN 978-84-9082-142-8..
