متانول
| متانول | |||
|---|---|---|---|
| |||
| |||
دیگر نامها Hydroxymethane Methyl alcohol | |||
| شناساگرها | |||
| شماره ثبت سیایاس | ۶۷-۵۶-۱ | ||
| پابکم | ۸۸۷ | ||
| کماسپایدر | ۸۶۴ | ||
| UNII | Y4S76JWI15 | ||
| شمارهٔ ئیسی | 200-659-6 | ||
| شمارهٔ یواِن | 1230 | ||
| KEGG | D02309 | ||
| MeSH | Methanol | ||
| ChEBI | CHEBI:17790 | ||
| ChEMBL | CHEMBL۱۴۶۸۸ | ||
| شمارهٔ آرتیئیسیاس | PC1400000 | ||
| 1098229 | |||
| 449 | |||
| 3DMet | B01170 | ||
| جیمول-تصاویر سه بعدی | Image 1 | ||
| |||
| |||
| خصوصیات | |||
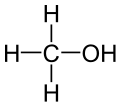
| فرمول مولکولی | C۱H۴O۱ | ||
| جرم مولی | ۳۲٫۰۴ g mol−1 | ||
| شکل ظاهری | Colorless liquid | ||
| چگالی | 0.7918 g cm-3 | ||
| دمای جوش | ۶۵ درجه سلسیوس (۱۴۹ درجه فارنهایت؛ ۳۳۸ کلوین) | ||
| log P | -0.69 | ||
| فشار بخار | 13.02 kPa (at 20 °C) | ||
| اسیدی (pKa) | 15.5[۲] | ||
| گرانروی | 5.9×10-4 Pa s (at 20 °C) | ||
| گشتاور دوقطبی | 1.69 D | ||
| خطرات[۳] | |||
| شاخص ئییو | 603-001-00-X | ||
| طبقهبندی ئییو | |||
| کدهای ایمنی | R۱۱, R23/24/25, R39/23/24/25 | ||
| شمارههای نگهداری | (S1/2), S۷, S۱۶, S36/37, S45 | ||
| لوزی آتش |  | ||
| نقطه اشتعال | |||
| دمای خودآتشگیری | |||
| محدودیتهای انفجار | ۳۶٪ | ||
| ترکیبات مرتبط | |||
| ترکیبات مرتبط | متانتیول سیلانول | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| | |||
| Infobox references | |||
|
| |||
متانول، متیل الکل، الکل متیلیک، کاربینول یا الکل چوب که سادهترین نوع الکلهاست با فرمول شیمیایی CH۳OH شناخته میشود. متانول از فعالیت بیهوازی گونههای زیادی از باکتریها تولید میشود و در نتیجه مقدار اندکی از بخار متانول وارد جو میشود و پس از چندین روز بهوسیله اکسیژن و با کمک نور خورشید اکسید شده به آب و دیاکسید کربن تبدیل میگردد. البته در فرایند سوختن متانول هم از نظر مواد بدست آمده چنین اتفاقی رخ میدهد ولی بسیار سریعتر. در ضمن شعله سوختن متانول بیرنگ است و باید مراقب بود تا شعله آن سبب سوختگی نشود. با این حال متانول به مراتب سمی تر از اتانول است. با تولید بیش از ۲۰ میلیون تن در سال، از آن به عنوان پیش ماده دیگر مواد شیمیایی کالایی از جمله فرمالدئید، اسید استیک، متیل ترت بوتیل اتر و همچنین میزبان مواد شیمیایی تخصصی تر استفاده میشود.
- ۲CH۳OH + 3 O۲ → ۲ CO۲ + ۴ H۲O
در سال ۱۹۲۳ شیمیدان آلمانی، «ماتیاس پیِر»، متانول را از گاز سنتز (مخلوطی از CO و H۲ که از کُک به دست میآید) تولید کرد. در این فرایند، از کروماتِ روی به عنوان کاتالیزور استفاده میشد و واکنش در شرایط سختی مانند فشار ۱۰۰۰–۳۰۰ اتمسفر و دمای حدود ۴۰۰ درجه سانتیگراد انجام میگرفت. در شیوهٔ مدرنِ تولید متانول، از کاتالیزورهایی استفاده میشود که در فشارهای پایین عمل میکنند و کارایی مؤثرتری دارند.
امروزه گاز سنتز مورد نظر برای تولید متانول مانند گذشته از زغال به دست نمیآید، بلکه از واکنش متان موجود در گازهای طبیعی تحت فشار ملایم ۱۰–۲۰ اتمسفر و دمای ۸۵۰ درجه سانتیگراد با بخار آب و در مجاورت کاتالیزور نیکل تولید میشود. CO و H۲ تولید شده، تحت تأثیر کاتالیزوری که مخلوطی از مس و اکسید روی و آلومینیوم است، واکنش داده، متانول ایجاد میکنند. این کاتالیزور نخستین بار در سال ۱۹۶۶ توسط ICI استفاده شد. این واکنش در فشار ۵۰–۱۰۰ اتمسفر و دمای ۲۵۰ درجه سانتیگراد صورت میگیرد.
روش دیگر تولید متانول، واکنش دیاکسیدکربن با هیدروژن اضافی است که تولید متانول و آب میکند.
واکنش در خون:متانول بعد از واکنش با خون به فرم آلدئید تبدیل میشود (در شبکیه عامل آسیب به عصب بینایی). فرم آلدئید در طی مدت کوتاه به اسید فرمیک تبدیل میشود (سمی تر و مخرب تر).
کاربرد
بهعنوان ضدیخ، حلال و سوخت بکار برده میشود. از متانول برای تقلیب اتانول نیز استفاده میشود، این عمل به منظور غیرقابل شرب نمودن اتانولی که برای مصارف صنعتی تولید میشود انجام میپذیرد (در کشورهای اسلامی به جهت مسائل شرعی و در کشورهای دیگر به جهت معافیت از مالیات فروش مواد مستکننده) بدین منظور از مواد دیگری چون پریدین و تربانتین نیز استفاده میشود.
متانول به صورت محدود به عنوان سوخت در موتورهایی با سیستم احتراق داخلی استفاده میشود. متانول تولید شده از چوب و سایر ترکیبات آلی را متانول آلی یا بیو الکل مینامند که یک منبع تجدید شدنی برای سوخت است و میتواند جایگزین مشتقات نفت خام شود. با این همه، از بیو الکل ۱۰۰ درصد نمیتوان در ماشینهای دیزلی بدون ایجاد تغییر در موتور ماشین استفاده کرد. متانول به عنوان حلال، ضدیخ و در تهیه سایر ترکیبات شیمیایی استفاده میشود.
۴۰ درصد از متانول تولیدی برای تهیه فرمالدئید استفاده میشود که آن هم در تهیه پلاستیک، تخته سه لایی، رنگ و مواد منفجره استفاده میشود. برای تغییر ماهیت اتانول صنعتی و جلوگیری از کاربرد آن به عنوان نوشیدنی، مقداری متانول به آن اضافه میکنند. دی متیل اتر از مشتقات متانول است که به جای CFCها در افشانههای آتروسل به عنوان پیشرانه استفاده میشود. همچنین از متانول در تهیه استیک اسید و متیل ترشیو بوتیل اتر نیز استفاده میشود.
شناسایی خطرات
فوقالعاده قابل احتراق بوده اما در دمای محیط آتش نمیگیرد. بین متانول و فلزاتی از قبیل پتاسیم، منیزیم، اکسیدکنندههایی مثل پرکلرات باریم، برومین کلرین، پراکسید هیدروژن و سدیم در صورت وجود حرارت خاصیت انفجاری ایجاد میکند متانول با کلروفرم، دی اتیل روی، کلریدسیانوریک و نیتریک اسید شدیداً واکنش میدهد. در صورت تجزیه حرارتی متانول به دی اکسیدکربن (CO2,CO) و فرمالدئید تولید میشود.
مواجهه گوارشی: شایعترین راه آلودگی و تماس، خوردن متانول میباشد. مسمومیت معمولاً به دنبال خوردن الکل اتیلیک آلوده به متانول رخ میدهد. مسمومیت اتفاقی و غیرعمدی بدنبال نوشیدن الکل اتانول آلوده به متانول در برخی کشورها از جمله ایران به صورت اپیدمی توده ای در تعداد زیادی افراد(Casualty Mass)به صورت همزمان دیده شدهاست.
تماس تنفسی: مواجهه با بخارات متانول در صورت آتش گرفتن یا بجوش آمدن رخ میدهد(°۶۵) و ممکن است در کارخانههای تولیدکننده متانول یا آزمایشگاه بصورت مسمومیت دسته جمعی دیده شود.
نکته: با توجه به این که متانول مادهای فرار است، در شرایطی مثل باز گذاشتن درِ بطری حاوی متانول تا چند روز، یا ریخته شدن مقدار زیادی بهطور اتفاقی در خانه، گازی که در این حالت از متانول آزاد میشود، ممکن است مخاط تنفسی را تحریک کند (مثلاً احساس خارش در گلو) اما چون مانند بخار متانول نیست، جایه نگرانی نیست، و اثر تخریبی آن ناچیز است، چراکه در حبابکهای شش، ماکروفاژها مستقر هستند، و عوامل بیگانه را به سرعت نابود میکنند؛ در واقع به این حالت گازی VOC میگویند. بنابراین بخارات هستند که از پوست و تنفس به راحتی جذب میشوند و سلامتی را تهدید میکنند.
تماس پوستی: مسمومیت به این شکل بسیار نادر است (نوزادان بیشتر در معرض هستند). اما با این حال مادهٔ بسیار نفوذ پذیری است؛ به طوری که در یک نایلون بسته شده حاوی متانول، ظرف ۴۸ ساعت، بخش قابل توجهی از متانول به صورت حالت مایع از آن عبور میکند. با این حال در مورد انسانها باید گفت که چون آنها مدام در فعالیت، تعریق و… هستند، احتمال نفوذ این ماده خیلی کمتر است.
نکته: اگر در تماس پوستی شدید به مدت چند روز با متانول بودید، باز هم شانس آسیب نخوردن به سیستم عصبی بالا است؛ با آزمایش بر عصب بینایی توسط پزشک میتوان از سلامت مغز هم مطمئن شد، چراکه همیشه عصب بینایی قبل از سیستم عصبی مرکزی مورد هدف متانول قرار میگیرد.بنابراین اگر عصب بیناییتان سالم است، به احتمال زیاد آسیبی هم به مغز نخورده، ولی برای اطمینان کامل میتوانید MRI انجام دهید(تحت نظر پزشک).
مفهوم سمی بودن متانول:در واقع متانول خود به تنهایی سمی نیست، بلکه در اثر تجزیه در کبد به مادهای سمی (اسید فرمیک) تبدیل میشود.
نکات ایمنی
متانول مادهای سمی است و نوشیدن آن موجب نابینایی و حتی مرگ میشود. هنگام استفاده از متانول باید از ماسک و دستکش استفاده کرد چون از طریق تنفس و پوست وآشامیدن نیز میتواند جذب شود. استفاده از دستکش و کفش مناسب مواد شیمیائی و ماسک صورت برای مقابله با بخارات متانول میباشد.
حساسیت نسبت به این موضوع خوب است، ولی افرادی که در خطر مواجهه با بخارات آن هستند (یعنی در کارخانهها و آزمایشگاهها)، نکات ایمنی دارای اهمیت است، چراکه بخار متانول در دمای اتاق وجود ندارد و ۶۵ درجه سانتیگراد نقطه جوش آن است. (یعنی در۶۶درجه به بالا به بخار تبدیل میشود)
نفوذ متانول به خون در اثر تماس پوستی خیلی نادر است و در حالت عادی نوزادان در خطرند و در مکانها، این کارخانهها هستند که باید رعایت زیادی را انجام دهند.
توصیه سازمان NIOSH برای مواجهه پوستی حداکثر ۱۰ ساعت کار مداوم در PPM ۲۰۰ و ۸ ساعت کار در PPM ۲۵۰ میباشد.
تصور اینکه از این ماده میشود به عنوان ضدعفونی کننده استفاده کرد، کاملاً اشتباه است (مانند الکل صنعتی به رنگهای زرد یا قرمز).
اقدامات اورژانسی
پس از مسمومیت با متانول باید سریعاً الکل اتانول به صورت وریدی یا خوراکی برای بیمار شروع و دیالیز انجام شود. در صورت شک قوی به مسمومیت با متانول بایستی درمان به سرعت در نزدیکترین مرکز درمانی شروع شود و هرگز نبایستی منتظر نتیجه سطح سرمی متانول ماند. در صورت تماس الکل با چشم باید ۱۵ تا ۲۰ دقیقه چشمتان را بشوییدو بعد به چشم پزشک مراجعه کنید.
منابع
- ↑ "Methanol". The PubChemProject. USA: National Center for Biotechnology Information.
- ↑ Ballinger, P.; Long, F.A. (1960). "Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds". J. Am. Chem. Soc. 82 (4): 795–798. doi:10.1021/ja01489a008.
- ↑ "The Emergency Response Safety and Health Database: Systematic Agent: METHANOL". Centers for Disease Control and Prevention. Retrieved 26 August 2009.
pharmacology vetrinary azad karaj <javadtakdehghan> ویکیپدیای انگلیسی http://daneshnameh.roshd.ir/mavara/mavara-index.php?page=متانول&SSOReturnPage=Check&Rand=0
https://blogs.cdc.gov/niosh-science-blog/2014/02/04/world-cancer-day/ https://en.m.wikipedia.org/wiki/Mass-casualty_incident https://fa.m.wikipedia.org/wiki/ترکیبات_آلی_فرار https://www.cdc.gov/niosh/topics/chemical.html https://www.cdc.gov/niosh/ershdb/emergencyresponsecard_29750029.html