N-butyylilitium
| Tämän artikkelin tai sen osan muoto tai tyyli kaipaa korjausta. Voit auttaa Wikipediaa parantamalla artikkelia. Lisää tietoa saattaa olla keskustelusivulla. Tarkennus: Artikkeli on kirjoitettu tavalla jota tavallisen kansalaisen on lähes mahdoton ymmärtää, monet termit vaativat kansantajuisempia selvennöksiä |
| n-Butyylilitium | |
|---|---|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| SMILES | [Li+].CCC[CH2-][1] |
| Ominaisuudet | |
| Molekyylikaava | C4H9Li |
| Moolimassa | 64,053 g/mol |
| Sulamispiste | –76 °C[2] |
| Kiehumispiste | Hajoaa 100–150 °C lämpötilassa[3] |
| Tiheys | 0,765 g/cm3[2] |
| Liukoisuus veteen | Liukenee hiilivetyihin[3] |
n-Butyylilitium on litiumin organometalliyhdiste eli niin kutsuttu organolitiumyhdiste. Ainetta käytetään erittäin vahvana emäksenä orgaanisen kemian synteeseissä.
Ominaisuudet
[muokkaa | muokkaa wikitekstiä]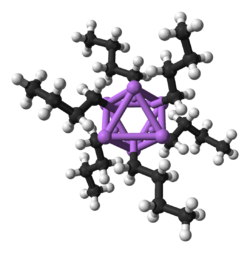
n-Butyylilitium on huoneenlämpötilassa nestettä, joka reagoi voimakkaasti ilman tai kosteuden kanssa. Tämän vuoksi sitä käytetään ja säilytetään tyypillisesti liuoksena. n-Butyylilitium liukenee hiilivetyihin, kuten heksaaniin ja tolueeniin, sekä tetrahydrofuraaniin. Liuoksissa yhdisteelle on tyypillistä muodostaa klustereita liuotinmolekyylien kanssa. Hiilivedyissä se muodostaa heksameerin ja tetrahydrofuraaniliuoksissa tetrameerin. Tetrameeri on rakenteeltaan vääristynyt kuutio. Klustereiden muodostumista voidaan vähentää ja reaktiivisuutta parantaa lisäämällä liuoksiin tetrametyleenidiamiinia tai heksametyylifosforiamidia. Nämä ovat nukleofiilisempia kuin hiilivedyt ja muodostavat butyylilitiumin kanssa monomeerisiä tai dimeerisiä ja reaktiivisempia komplekseja.[2][4][5]
Kuumennettaessa n-butyylilitium hajoaa muodostaen litiumhydridiä ja 1-buteenia.[3]
Valmistus
[muokkaa | muokkaa wikitekstiä]n-Butyylilitiumia valmistetaan litiummetallin reaktiolla 1-klooributaanin tai 1-bromibutaanin kanssa. Sivutuotteena reaktioissa muodostuu litiumkloridia tai litiumbromidia. Valmistuksessa käytetään liuottimena hiilivetyjä. Muodostuneet liukenemattomat yhdisteet sekä litiummetalliylimäärä poistetaan suodattamalla.[2] Viimeiseksi n-butyylilitium puhdistetaan tislaamalla alipaineessa 80–100 °C lämpötilassa[3].
- C4H9Cl + 2 Li → C4H9Li + LiCl
Käyttö
[muokkaa | muokkaa wikitekstiä]
Suurin n-butyylilitiumin käyttökohde on isopreeni- ja butadieenikumien valmistus[3], jossa sitä käytetään polymerointireaktioiden initiaattorina. n-Butyylilitiumia käytettäessä stereoselektiivisyys on erittäin hyvä isopreenikumeja valmistettaessa, jopa Ziegler–Natta-katalyyttien luokkaa. Butadieenikumeissa stereoselektiivisyys ei ole yhtä hyvä.[2]
n-Butyylilitium on erittäin vahva emäs joka kykenee deprotonoimaan alkoholeja, amiineja ja jopa tiettyjä hiilivetyjä. Sillä on käyttöä myös muiden organolitiumyhdisteiden valmistuksessa, esimerkiksi aromaattisten yhdisteiden ortolitioinnilla, sekä erittäin vahvasti emäksisten, mutta vain hieman nukleofiilisten yhdisteiden esimerkiksi litiumdi-isopropyyliamidin, litiumbis(trimetyylisilyyli)amidin ja litiumtetrametyylipiperididin valmistuksessa.[2][5]
Katso myös
[muokkaa | muokkaa wikitekstiä]Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ butyllithium – Substance summary NCBI. Viitattu 25. joulukuuta 2011.
- ↑ a b c d e f Ulrich Wietelmann, Richard J. Bauer: "Lithium and Lithium Compounds", tepoksessa Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2002.
- ↑ a b c d e Raimo Alén: Kokoelma orgaanisia yhdisteitä, s. 796. Consalen Consulting, 2009. ISBN 978-952-92-5627-3
- ↑ Francis A. Carey & Richard J. Sundberg: Organic Chemistry A: Structure and Mechanisms, s. 588. Springer, 2007. ISBN 978-0-387-44897-8 (englanniksi)
- ↑ a b Didier Astruc: Organometallic chemistry and catalysis, s. 298. Springer, 2007. ISBN 978-3-540-46128-9 Kirja Googlen teoshaussa (viitattu 25.12.2011). (englanniksi)