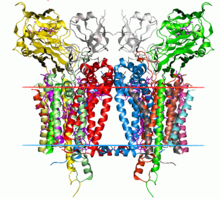
Complexe cytochrome b6f
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Le complexe cytochrome b6f, ou complexe de cytochromes b6f, est une oxydoréductase qui catalyse la réaction :
- plastoquinol + 2 plastocyanines oxydées + 2 H+face 1 plastoquinone + 2 plastocyanines réduites + 2 H+face 2.
Cette réaction est analogue à celle catalysée par la coenzyme Q-cytochrome c réductase de la chaîne respiratoire dans les mitochondries. Ce complexe enzymatique est présent dans la membrane des thylakoïdes, organites présents chez les cyanobactéries ainsi qu'à l'intérieur des chloroplastes, eux-mêmes organites photosynthétiques des algues vertes et des plantes. Il a pour fonction d'accumuler des protons dans le lumen des thylakoïdes lors du transfert des électrons à haut potentiel du photosystème II vers le photosystème I.
Structure
[modifier | modifier le code]Le complexe cytochrome b6f est un dimère dont chaque monomère est composé de huit sous-unités[2], à savoir quatre grosses sous-unités :
- un cytochrome f avec un cytochrome de type c pour une masse de 32 kDa (sous-unité PetA) ;
- un cytochrome b6 avec un groupe héminique à potentiel haut et potentiel bas pour une masse de 25 kDa (PetB) ;
- une protéine de Rieske contenant un cluster fer-soufre [2Fe-2S] pour une masse de 19 kDa (PetC) ;
- une sous-unité IV de 17 kDa (PetD) ;
et quatre petites sous-unités de 3 à 4 kDa chacune et appelées PetG, PetL, PetM et PetN[2]. La masse totale atteint 217 kDa.
La structure cristallisée de complexes cytochrome b6f de Chlamydomonas reinhardtii, Mastigocladus laminosus and Nostoc sp. PCC 7120 ont été déterminées[1],[3],[4]. La structure du complexe est semblable à celle du cytochrome bc1. Le cytochrome b6 et la sous-unité IV sont semblables au cytochrome b, tandis que les protéines de Rieske des deux complexes sont homologues[5]. Cependant, le cytochrome f et le cytochrome c1 ne sont pas homologues[6].
Le complexe cytochrome b6f contient sept groupes prosthétiques[7],[8]. Quatre d'entre eux sont présents à la fois dans le cytochrome b6f et dans le cytochrome bc1 :
- la molécule d'hème c, présente dans le cytochrome c1 et dans le cytochrome f ;
- les deux molécules d'hème b ;
- le cluster fer-soufre [2Fe-2S] des protéines de Rieske.
Les trois autres groupes prosthétiques ne se trouvent que dans les cytochrome b6f[1] :
- la chlorophylle a ;
- le
β -carotène ; - l'hème cn, également appelé « hème x ».
Fonctionnement biologique
[modifier | modifier le code]Dans la photosynthèse, le complexe cytochrome b6f intervient dans le transfert des électrons entre deux centres réactionnels, du photosystème II au photosystème I tout en pompant des protons à travers la membrane des thylakoïdes depuis le stroma des chloroplastes vers le lumen des thylakoïdes[9]. C'est la circulation des électrons à travers le complexe cytochrome b6f qui génère le gradient de concentration en protons, et donc le gradient électrochimique, à travers la membrane des thylakoïdes, gradient utilisé pour la phosphorylation de l'ADP en ATP dans les chloroplastes.
À travers une réaction distincte, le complexe cytochrome b6f joue un rôle central dans la photophosphorylation cyclique, lorsqu'il n'y a pas de NADP+ disponible pour recevoir les électrons de la ferrédoxine réduite. Ce cycle intervient également dans le processus de photosynthèse[10] pour maintenir le ratio de production ATP / NADPH approprié pour la fixation du carbone[11].

Notes et références
[modifier | modifier le code]- (en) David Stroebel, Yves Choquet, Jean-Luc Popot et Daniel Picot, « An atypical haem in the cytochrome b6f complex », Nature, vol. 426, , p. 413-418 (lire en ligne) DOI 10.1038/nature02155
- (en) Julian P. Whitelegge, Huamin Zhang, Rodrigo Aguilera, Ross M. Taylor et William A. Cramer, « Full Subunit Coverage Liquid Chromatography Electrospray Ionization Mass Spectrometry (LCMS+) of an Oligomeric Membrane Protein – Cytochrome b6f Complex From Spinach and the Cyanobacterium Mastigocladus Laminosus », Molecular & Cellular Proteomics, vol. 1, , p. 816-827 (lire en ligne) DOI 10.1074/mcp.M200045-MCP200
- (en) E. Yamashita, H. Zhang et W.A. Cramer, « Structure of the Cytochrome b6f Complex: Quinone Analogue Inhibitors as Ligands of Heme cn », Journal of Molecular Biology, vol. 370, no 1, , p. 39-52 (lire en ligne) DOI 10.1016/j.jmb.2007.04.011
- (en) Danas Baniulis, Eiki Yamashita, Julian P. Whitelegge, Anna I. Zatsman, Michael P. Hendrich, S. Saif Hasan, Christopher M. Ryan et William A. Cramer, « Structure-Function, Stability, and Chemical Modification of the Cyanobacterial Cytochrome b6f Complex from Nostoc sp. PCC 7120 », Journal of Biological Chemistry, vol. 284, , p. 9861-9869 (lire en ligne) DOI 10.1074/jbc.M809196200
- (en) Christopher J Carrell, Huamin Zhang, William A Cramer et Janet L Smith, « Biological identity and diversity in photosynthesis and respiration: structure of the lumen-side domain of the chloroplast Rieske protein », Structure, vol. 5, no 12, , p. 1613-1625 (lire en ligne) DOI 10.1016/S0969-2126(97)00309-2
- (en) Sergio E Martinez, Deru Huang, Andrzej Szczepaniak, William A Cramer et Janet L Smith, « Crystal structure of chloroplast cytochrome freveals a novel cytochrome fold and unexpected heme ligation », Structure, vol. 2, no 2, , p. 95-105 (lire en ligne) DOI 10.1016/S0969-2126(00)00012-5
- (en) D. Baniulis, E. Yamashita, H. Zhang, S. S. Hasan et W. A. Cramer, « Structure–Function of the Cytochrome b6f Complex », Photochemistry and Photobiology, vol. 84, no 6, , p. 1349-1358 (lire en ligne) DOI 10.1111/j.1751-1097.2008.00444.x
- (en) William A. Cramer, Huamin Zhang, Jiusheng Yan, Genji Kurisu et Janet L. Smith, « Evolution of Photosynthesis: Time-Independent Structure of the Cytochrome b6f Complex », Biochemistry, vol. 43, no 20, , p. 5921-5929 (lire en ligne) DOI 10.1021/bi049444o
- (en) Genji Kurisu, Huamin Zhang, Janet L. Smith et William A. Cramer, « Structure of the Cytochrome b6f Complex of Oxygenic Photosynthesis: Tuning the Cavity », Science, vol. 302, no 5647, , p. 1009-1014 (lire en ligne) DOI 10.1126/science.1090165
- (en) Yuri Munekage, Mihoko Hashimoto, Chikahiro Miyake, Ken-Ichi Tomizawa, Tsuyoshi Endo, Masao Tasaka et Toshiharu Shikanai, « Cyclic electron flow around photosystem I is essential for photosynthesis », Nature, vol. 429, , p. 579-582 (lire en ligne) DOI 10.1038/nature02598
- (en) Derek S. Bendall et Robert S. Manasse, « Cyclic photophosphorylation and electron transport », Biochimica et Biophysica Acta (BBA) - Bioenergetics, vol. 1229, no 1, , p. 23-38 (lire en ligne) DOI 10.1016/0005-2728(94)00195-B