Cyclooctène
| Cyclooctène | |
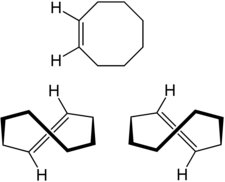 Structure du Z-cyclooctène (en haut) et énantiomères planaires du E-cyclooctène (en bas), (S)-(+)-E-cyclooctène (à gauche) et (R)-(–)-E-cyclooctène (à droite) |
|
| Identification | |
|---|---|
| Nom UICPA | cyclooctène |
| No CAS | (racémique du E-cyclooctène) (isomère Z ou cis) |
| No ECHA | 100.012.041 |
| No CE | 213-245-5 (racémique du E-cyclooctène) 213-243-4 (isomère Z ou cis) |
| PubChem | 638079 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C8H14 [Isomères] |
| Masse molaire[1] | 110,196 8 ± 0,007 4 g/mol C 87,19 %, H 12,81 %, |
| Propriétés physiques | |
| T° fusion | −16 °C[2] |
| T° ébullition | 148 °C[2] |
| Masse volumique | 0,847 g·cm-3[2] à 20 °C |
| T° d'auto-inflammation | 280 °C[2] |
| Point d’éclair | 24 °C[2] |
| Précautions | |
| SGH[2] | |
| H226, H304, H410, P210, P243, P273, P331, P301+P310 et P403+P233 |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le cyclooctène est un cycloalcène à 8 atomes de carbone. C'est le plus léger des cycloalcènes possédant deux isomères Z et E. La forme Z (ou cis) est la plus commune. La forme E (ou trans), quant à elle, possède une propriété très particulière : elle présente une chiralité planaire ; il y a donc deux énantiomères du E-cyclooctène :
- (Rp)-(–)-E-cyclooctène, numéro CAS
- (Sp)-(+)-E-cyclooctène, numéro CAS

|
|
| Z-cyclooctène | R-E-cyclooctène |
Z-cyclooctène (isomère cis)
[modifier | modifier le code]Le Z-cyclooctène est un substrat bien connu pour donner un époxyde de façon très sélective, par rapport à d'autres cycloalcènes, comme le cyclohexène, en ne formant que de faibles quantités de sous-produits. La raison en est que la fonctionnalisation allylique est plus difficile pour le Z-cyclooctène que pour d'autres cycloalcènes du fait des liaisons C–H allyliques pratiquement orthogonales. Par conséquent, si des radicaux se trouvent à proximité, ils auront davantage tendance à former un époxyde (par un mécanisme d'addition-élimination) plutôt que des sous-produits allyliques.
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Cyclooctene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 6 février 2013 (JavaScript nécessaire)




