Trichlorure de plutonium
| Trichlorure de plutonium | |
| |
| __ Pu3+ __ Cl− | |
| Identification | |
|---|---|
| Nom UICPA | chlorure de plutonium(III) |
| No CAS | |
| PubChem | 19902959 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | PuCl3 |
| Masse molaire[1] | 350 g/mol Cl 30,39 %, Pu 69,73 %, |
| Propriétés physiques | |
| T° fusion | 767 °C [réf. nécessaire] |
| T° ébullition | 1 727 °C[réf. nécessaire] |
| Masse volumique | 5,70 g·cm-3[réf. nécessaire] |
| Précautions | |
 Composé radioactif |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
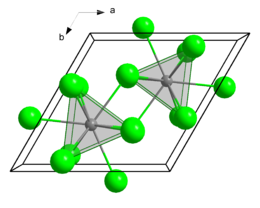
Le trichlorure de plutonium, ou chlorure de plutonium(III), est un composé chimique de formule PuCl3. Il se présente sous la forme d'un solide cristallisé vert fondant à 767 °C et soluble dans l'eau et les acides dilués en donnant une solution bleue. Il forme avec l'eau des mono-, tri- et hexahydrates. Il cristallise dans le système cristallin hexagonal et le groupe d'espace P63/m (no 176) avec les paramètres a = 739 pm et c = 424 pm, et deux atomes de plutonium par maille cristalline. Sa structure cristalline est semblable à celle du trichlorure d'uranium UCl3. Les atomes de plutonium sont entourés chacun par 9 atomes de chlore formant un prisme trigonal tricappé comme polyèdre de coordination[2].
Préparation
[modifier | modifier le code]Le trichlorure de plutonium peut être obtenu en faisant réagir du plutonium avec du chlore sous vide ou sous atmosphère de tétrachlorure de carbone-argon :
On peut également le produire en faisant réagir du dioxyde de plutonium PuO2 avec du tétrachlorure de carbone CCl4 :
Il est également possible de produire du trichlorure de plutonium par chloration d'un hydroxyde de plutonium(IV) Pu(OH)4 avec du chlorure d'hydrogène HCl, par conversion de plutonium en hydrure de plutonium puis chloration ultérieure par le chlorure d'hydrogène, on enfin en faisant réagir du décahydrate d'oxalate de plutonium(III) Pu2(C2O4)3·10H2O avec de l'hexachloropropène CCl3CCl=CCl2.
Toxicité
[modifier | modifier le code]Le trichlorure de plutonium n'est pas répertorié dans le règlement CLP, bien que sa toxicité soit connue. Elle relève à la fois de la toxicité chimique de ses constituants (le plutonium est un métal lourd très toxique) et de la radiotoxicité inhérente à la radioactivité du plutonium.
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) John H. Burns, « Crystallographic studies of some transuranic trihalides: 239PuCl3, 244CmBr3, 249BkBr3 and 249CfBr3 », Journal of Inorganic and Nuclear Chemistry, vol. 37, no 3, , p. 743-749 (DOI 10.1016/0022-1902(75)80532-X, lire en ligne)
