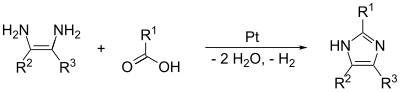Imidazol
| Imidazol | |
|---|---|

|

|
|

|
 | |
1H-Imidazol | |
Outros nomes 1,3-diazol | |
| Identificadores | |
| Número CAS | 288-32-4 |
| PubChem | 795 |
| ChemSpider | 773 |
| Número CE | 206-019-2 |
| KEGG | C01589 |
| ChEBI | CHEBI:16069 |
| ChEMBL | CHEMBL540 |
| Número RTECS | NI3325000 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C3H4N2 |
| Masa molecular | 68,077 g/mol |
| Aspecto | sólido branco ou amarelo claro |
| Densidade | 1,23 g/cm3, sólido |
| Punto de fusión | 89–91 °C; 192–196 °F; 362–364 K |
| Punto de ebulición | 256 °C; 493 °F; 529 K |
| Solubilidade en auga | 633 g/L |
| Acidez (pKa) | 6,95 (para o ácido conxugado) [1] |
| 206 nm | |
| Estrutura | |
| Estrutura cristalina | monoclínico |
| anel de 5 membros plano | |
| Momento dipolar | 3,61 D |
| Perigosidade | |
| declaración de perigosidade GHS | 302, 314, 360, 360D |
| declaración de precaución GHS | 201, 280, 305+351+338, 310, 330 [2] |
| Principais perigos | Corrosivo |
| Punto de inflamabilidade | 146 °C; 295 °F; 419 K |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O imidazol é un composto orgánico coa fñormula C3N2H4. É un sólido branco ou incoloro soluble en auga, que produce unha disolución medianamente alcalina. En química, é un composto heterocíclico aromático, clasificado como un diazol e ten átomos de nitróxeno non adxacentes.
Moitos produtos naturais, especialmente alcaloides, conteñen o anel imidazol. Estes imidazois comparten o anel 1,3-C3N2 pero presentan diversos substituíntes. Este sistema anular está presente en importantes moléculas biolóxicas, como o aminoácido histidina e a hormona relacionada histamina. Moitos fármacos conteñen o anel imidazol, como certos antifúnxicos, a serie de antibióticos de nitroimidazol e o sedante midazolam.[3][4][5][6][7]
Cando se fusiona cun anel de pirimidina, forma unha purina, que é o composto heterocíclico que contén nitróxeno máis abondoso na natureza.[8]
O nome "imidazol" (imidazole) foi acuñado en 1887 polo químico alemán Arthur Rudolf Hantzsch (1857–1935).[9]
Estrutura e propiedades
[editar | editar a fonte]O imidazol é un anel de 5 membros plano. Pode existir en dúas formas tautoméricas, porque o hidróxeno pode unirse a calquera dos dous átomos de nitróxeno. O imidazol é un composto altamente polar, como evidencia o seu momento dipolar eléctrico de 3,67 D.[10] É moi soluble en auga. Clasifícase como composto aromático debido á presenza dun anel plano que contén 6 electróns
Velaquí algunhas estruturas resonantes do imidazol:
Anfoterismo
[editar | editar a fonte]O imidazol é anfótero. É dicir, pode funcionar como ácido ou coma base. Como ácido, o pKa do imidazol é 14,5, polo que é menos ácido que os ácidos carboxílicos, fenois e imidas, pero lixeiramente máis ácido que os alcohois. O protón ácido é o que está unido ao nitróxeno. A desprotonación dá lugar ao anión imidazol, que é simétrico. Como base, o pKa do ácido conxugado (citado como pKBH+ para evitar confusión entre os dous) é aproximadamente 7, polo que o imidaol é unhas sesenta veces máis básico que a piridina. O sitio básico é o nitróxeno co par solitario (e non unido ao hidróxeno). A protonación dá lugar ao catión imidazolio, que é simétrico.
Preparación
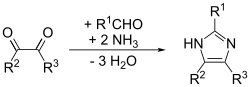
[editar | editar a fonte]O descubrimento do imidazol fíxoo en 1858 o químico xermano-británico Heinrich Debus, aínda que xa se descubriran antes na década de 1840 varios derivados do imidazol. O glioxal, o formaldehido e o amoníaco condénsanse para formar imidazol (glioxalina, como foi denominado orixinalmente).[11] Esta síntese, aínda que produce un rendemento relativamente baixo, aínda se usa para xerar imidazois C-substituídos.
Nunha modificación de microondas, os reactivos son bencilo, benzaldehido e amoníaco en ácido acético glacial, formando 2,4,5-trifenilimidazol ("lofina").[12]
O imidazol pode sintetizarse por numerosos métodos ademais de polo método de Debus. Moitas destas sínteses poden tamén aplicarse a imidazois substituídos variando os grupos funcionais nos reactivos. Estes métodos categorízanse normalmente polo número de compoñentes reactivos.
- Un compoñente
O enlace (1,5) ou (3,4) pode formarse pola reacción dun imidato e un
- Dous compoñentes
Os enlaces (1,2) e (2,3) poden formarse tratando un 1,2-diaminoalcano, a altas temperaturas, cun alcohol, aldehido, ou ácido carboxílico. Cómpre usar un catalizador deshidroxenante, como o platino en alúmina.
Os enlaces (1,2) e (3,4) poden tamén formarse a partir de
- Tres compoñentes
Este método ten bos rendementos para os imidazois substituídos. Unha adaptación do método de Debus, denomínase síntese de imadazol de Debus-Radziszewski. Os materiais de inicio son glioxal substituído, aldehido, amina e amoníaco ou sal de amonio.[13]
- Formación a partir doutros heterociclos
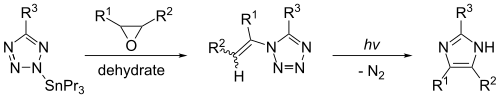
Pode sintetizarse imidazol por fotólise de 1-viniltetrazol. Esta reacción só dá un rendemento substancial se o 1-viniltetrazol se produce eficientemente a partir dun composto orgánico, como o 2-tributilestaniltetrazol. A reacción, que se mostra abaixo, produce imidazol cando R1 = R2 = R3 = hidróxeno.
O imidazol pode tamén formarse nunha reacción en fase de vapor. A reacción ocorre con formamida, etilenediamina e hidróxeno sobre platino en alúmina, e debe ter lugar entre 340 e 480 °C. Isto forma un produto de imidazol moi puro.
- Reacción de Van Leusen[14]
A reacción de Van Leusen pode tamén empregarse para formar imidazois que empezan a partir de TosMIC (tosilmetil isocianuro) e unha aldimina. A síntese de imidazol de Van Leusen permite a preparación de imidazois a partir de aldiminas por reacción con TosMIC. A reacción foi posteriormente ampliada a unha síntese de dous pasos na cal a aldimina se xera in situ: a reacción de Van Leusen de tres compoñentes (vL-3CR).
Significado biolóxico e aplicacións
[editar | editar a fonte]O imidazol incorpórase a moléculas biolóxicas moi importantes. A máis frecuente é o aminoácido histidina, que ten unha cadea lateral imidazol. A histidina está presente en moitas proteínas e enzimas e desempeña un importante papel na estrutura e función de enlace da hemoglobina. Os compostos de histidina baseados no imidazol desempeñan unha importante función no tmponamento intracelular.[15] A histidina pode ser descarboxilada a histamina, que é tamén un composto biolóxico común. A histamina pode causar urticaria cando se produce durante as reaccións alérxicas. A relación entre a histidina e a histamina móstrase a continuación:
Unha das aplicacións do imidazol é na purificación de proteínas etiquedadas con histidina (His) en cromatografía de afinidade de metal inmobilizado (IMAC). O imidazol utilízase para eluír as proteínas etiquetadas unidas a ións níquel adheridos á superficie de esferas na columna de cromatografía. Pola columna pasa un exceso de imidazol, que despraza a etiqueta His da coordinación co níquel, liberando as proteínas etiquetadas con His.
O imidazol converteuse nunha parte importante de moitos fármacos. Os imidazois sintéticos están presentes en moitos funxicidas e medicamentos antifúnxicos, antiprotozoarios e antihipertensivos. O imidazol forma parte da molécula de teofilina, que se encontra nas follas e grans de café, que estimula o sistema nervioso central. Está presente tamén no medicamento anticanceroso mercaptopurina, que combate a leucemia ao interferir coas actividades do ADN.
Varios imidazois substituídos, como o clotrimazol, son inhibidores selectivos da óxido nítrico sintase, o que os converte en interesantes dianas de drogas nas inflamacións, enfermidades neurodexenerativas e tumores do sistema nervioso.[16][17] Outras actividades biolóxicas do farmacóforo imidazol están relacionadas coa regulación á baixa dos fluxos de Ca2+ K+ intracelulares e a interferencia co inicio da tradución.[18]
Derivados farmacéuticos
[editar | editar a fonte]Os derivados de imidazol substituídos son un valioso tratamento de moitas infeccións sistémicas fúnxicas.[19] Os imidazois pertencen á clase dos antifúnxicos de azol, entre os que están o cetoconazol, o miconazol e o clotrimazol.
Como comparación, outro grupo de azois é o dos triazois, que inclúe o fluconazol, itraconazol e voriconazol. A diferenza entre os imidazois e os triazois implica o mecanismo de inhibición do enzima citocromo P450. O N3 do composto imidazol únese ao áromo de ferro do hemo do citocromo P450 férrico, mentres que o N4 dos triazois únese ao grupo hemo. Os triazois teñen unha maior especificidade polo citocromo P450 que os imidazois, polo que son máis potentes que os imidazois.[20]
Algúns derivados de imidazois presentan efectos sobre os insectos, por exemplo o nitrato de sulconazol mostra un forte efecto anti-alimentación sobre a larva do escaravello australiano que dixire a queratina da especie Anthrenocerus australis, como tamén ten o nitrato de econazol sobre a couza da roupa Tineola bisselliella.[21]
Aplicacións industriais
[editar | editar a fonte]O imidazol foi amplamente utilizado como inhibidor da corrosión sobre ceertos metais de transición, como o cobre. É importante impedir a corrosión do cobre, especialmente en sistemas acuosos, onde a condutividade eléctrica do cobre diminúe debido á corrosión. Os imidazois poden tamén utilizarse como axentes para sintetizar zeollitas.
Moitos compostos de importancia industrial e tecnolóxica conteñen derivados do imidazol. O polibencimidazol (PBI) termoestable contén imidazol fusionado a un anel de benceno e enlazado ao benceno, e actúa como un retardante do lume. O imidazol pode encontrarse tamén en varios compostos usados en fotografía e electrónica.
Sales de imidazol
[editar | editar a fonte]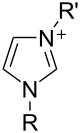
Os sales de imidazol, nos que o anel imidazol está no catión coñécense como sales de imidazolio (por exemplo, nitrato ou cloruro de imidazolio).[22] Estes sales fórmanse a partir da protonación ou substitución no nitróxeno do imidazol. Foron utilizados como líquidos iónicos e precursores de carbenos estables. Os sales nos que un imidazol desprotonado é un anión son tamén ben coñecidos; estes sales denomínanse imidazolatos (por exemplo, o imidazolato de sodio, NaC3H3N2).
Heterociclos relacionados
[editar | editar a fonte]- Bencimidazol, un análogo cun anel bencénico fusionado.
- Dihidroimidazol ou imidazolina, un análogo no que o dobre enlace 4,5 está saturado.
- Pirrol, un análogo cun só átomo de nitróxeno en posición 1.
- Oxazol, un análogo co átomo de nitróxeno en posición 1 substituído por un oxíxeno.
- Tiazol, un análogo co átomo de nitróxeno en posición 1 substituído por un xofre.
- Pirazol, un análogo con dous átomos de nitróxeno adxacentes.
- Triazois, análogos con tres átomos de nitróxeno.
Notas
[editar | editar a fonte]- ↑ Walba, H.; Isensee, R. W. (1961). "Acidity constants of some arylimidazoles and their cations". J. Org. Chem. 26 (8): 2789–2791. doi:10.1021/jo01066a039.
- ↑ "Imidazole".
- ↑ Karitzky, A. R.; Rees (1984). Comprehensive Heterocyclic Chemistry 5. pp. 469–498.
- ↑ Grimmett, M. Ross (1997). Imidazole and Benzimidazole Synthesis. Academic Press.
- ↑ Brown, E. G. (1998). Ring Nitrogen and Key Biomolecules. Kluwer Academic Press.
- ↑ Pozharskii, A. F.; et al. (1997). Heterocycles in Life and Society. John Wiley & Sons.
- ↑ Gilchrist, T. L. (1985). Heterocyclic Chemistry. Bath Press. ISBN 978-0-582-01421-3.
- ↑ Rosemeyer, H. (2004). "The Chemodiversity of Purine as a Constituent of Natural Products". Chemistry & Biodiversity 1 (3): 361–401. PMID 17191854. doi:10.1002/cbdv.200490033.
- ↑ Hantzsch, A. and Weber, J. H. (1887) "Ueber Verbindungen des Thiazols (Pyridins der Thiophenreihe)" (Sobre os compostos de tiazol (piridinas da serie do tiofeno), Berichte der deutschen chemischen Gesellschaft, 20 : 3118–3132, see p. 3119. Ver tamén: Hantzsch, A. (1888) "Allegemeine Bemerkungen über Azole" (Observacións xerais sobre os azois), Annalen der Chemie, 249 : 1–6. Hantzsch propuxo unha reforma da nomenclatura dos compostos de azol, incluíndo unha proposta para chamar o anel heterocíclico C3H3(NH)N "imidazole" ; ver pp. 2 e 4.
- ↑ Christen, Dines; Griffiths, John H.; Sheridan, John (1981). "The Microwave Spectrum of Imidazole; Complete Structure and the Electron Distribution from Nuclear Quadrupole Coupling Tensors and Dipole Moment Orientation". Zeitschrift für Naturforschung A 36 (12): 1378–1385. Bibcode:1981ZNatA..36.1378C. doi:10.1515/zna-1981-1220.
- ↑ Debus, Heinrich (1858). "Ueber die Einwirkung des Ammoniaks auf Glyoxal" [On the reaction of ammonia upon glyoxal]. Annalen der Chemie und Pharmacie 107 (2): 199–208. doi:10.1002/jlac.18581070209. Na p. 205: "Die gereinigte Substanz stellt das oxalsaure Salz einer Basis dar, die ich mit Glyoxalin bezeichenen werde." (A substancia purificada constitúe o sal oxálico dunha base, que designarei como "glioxalina".)
- ↑ Crouch, R. David; Howard, Jessica L.; Zile, Jennifer L.; Barker, Kathryn H. (2006). "Microwave-Mediated Synthesis of Lophine: Developing a Mechanism To Explain a Product". J. Chem. Educ. 83 (11): 1658. Bibcode:2006JChEd..83.1658C. doi:10.1021/ed083p1658.
- ↑ Modelo:US patent reference
- ↑ Van Leusen, Albert M.; Wildeman, Jurjen; Oldenziel, Otto H. (1977). "Chemistry of sulfonylmethyl isocyanides. 12. Base-induced cycloaddition of sulfonylmethyl isocyanides to carbon, nitrogen double bonds. Synthesis of 1,5-disubstituted and 1,4,5-trisubstituted imidazoles from aldimines and imidoyl chlorides". Journal of Organic Chemistry 42 (7): 1153–1159. Bibcode:1977JOrgC..42.1153A. doi:10.1021/jo00427a012.
- ↑ Hochachka, P. W.; Somero, G. N. (2002). Biochemical Adaptation: Mechanisms and Process in Physiological Evolution. New York: Oxford University Press.
- ↑ Castaño, T.; Encinas, A.; Pérez, C.; Castro, A.; Campillo, N. E.; Gil, C. (2008). "Design, synthesis, and evaluation of potential inhibitors of nitric oxide synthase" (PDF). Bioorg. Med. Chem. (Submitted manuscript) 16 (11): 6193–6206. PMID 18477512. doi:10.1016/j.bmc.2008.04.036. hdl:10261/87090.
- ↑ Bogle, R. G.; Whitley, G. S.; Soo, S. C.; Johnstone, A. P.; Vallance, P. (1994). "Effect of anti-fungal imidazoles on mRNA levels and enzyme activity of inducible nitric oxide synthase". Br. J. Pharmacol. 111 (4): 1257–1261. PMC 1910171. PMID 7518297. doi:10.1111/j.1476-5381.1994.tb14881.x.
- ↑ Khalid, M. H.; Tokunaga, Y.; Caputy, A. J.; Walters, E. (2005). "Inhibition of tumor growth and prolonged survival of rats with intracranial gliomas following administration of clotrimazole". J. Neurosurg. 103 (1): 79–86. PMID 16121977. doi:10.3171/jns.2005.103.1.0079.
- ↑ Leon Shargel. Comprehensive Pharmacy Review (6th ed.). p. 930.
- ↑ Davis, Jennifer L.; Papich, Mark G.; Heit, Mark C. (2009). "Chapter 39: Antifungal and Antiviral Drugs". En Riviere, Jim E.; Papich, Mark G. Veterinary Pharmacology and Therapeutics (9th ed.). Wiley-Blackwell. pp. 1019–1020. ISBN 978-0-8138-2061-3.
- ↑ Sunderland, M. R.; Cruickshank, R. H.; Leighs, S. J. (2014). "The efficacy of antifungal azole and antiprotozoal compounds in protection of wool from keratin-digesting insect larvae". Textile Res. J. 84 (9): 924–931. doi:10.1177/0040517513515312.
- ↑ Zolfigol, Mohammad A.; Khazaei, Ardeshir; Moosavi-Zare, Ahmad R.; Zare, Abdolkarim; Kruger, Hendrik G.; Asgari, Zhila; Khakyzadeh, Vahid; Kazem-Rostami, Masoud (2012-04-06). "Design of Ionic Liquid 3-Methyl-1-sulfonic Acid Imidazolium Nitrate as Reagent for the Nitration of Aromatic Compounds by in Situ Generation of NO2 in Acidic Media". The Journal of Organic Chemistry 77 (7): 3640–3645. ISSN 0022-3263. PMID 22409592. doi:10.1021/jo300137w.