Timocito
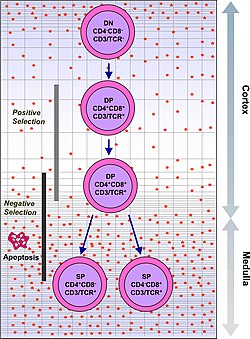
Un timocito é unha célula inmunitaria presente no timo antes de que sufra transformacións para converterse en célula T.[1] Os timocitos orixínanse a partir de células nais da medula ósea e chegan ao timo por vía sanguínea. A timopoese é o proceso por medio do que os timocitos se transforman en células T maduras despois de sufriren unha selección negativa ou positiva. Este proceso de selección ten unha importancia vital para converter a poboación de timocitos nunha poboación periférica de células T que teñan capacidade de responder ante patóxenos externos, pero sigan sendo tolerantes aos antíxenos corporais propios. A selección positiva selecciona células que poden unirse ás moléculas do complexo maior de histocompatibilidade de tipo MHC I e MHC II con polo menos unha feble afinidade. Isto elimina (por un proceso chamado "morte por ignorancia" ou indiferenza clonal) aquelas células T que que non serían funcionais debido á súa incapacidade de unirse ao MHC. A selección negativa destrúe os timocitos que teñan unha alta afinidade por MHC ou péptidos propios. Isto elimina células que dirixirían respostas inmunes contra proteínas propias na periferia. A selección negativa non é efectiva ao 100% e algunhas células T autorreactivas escapan e son liberadas á circulación. Existen mecanismos adicionais de tolerancia periférica que silencian estas células, mais se estes mecanismos fallan pode orixinarse unha autoinmunidade.
Estadios de maduración
[editar | editar a fonte]Os timocitos clasifícanse en varios estadios maduracionais baseándose nos marcadores que aparecen na superficie celular. O estadio inicial do timocito é o estadio dobre negativo (negativo tanto para CD4 coma para CD8), que máis recentemente foron mellor descritos como liñaxe-negativos, e que poden subdividirse en varios subestadios. O seguinte grande estadio é o estadio dobre positivo (positivo á vez para CD4 e CD8). O estadio final na maduración é o estadio simple positivo, para un só marcador (positivo para CD4 ou para CD8).
En ratos
[editar | editar a fonte]| Estadio | Marcadores de superficie definitorios | Localización | Eventos significativos |
| Dobre negaivo 1 ou ETP (Early T lineage Progenitor, Proxenitor da liñaxe T inicial) | Liñaxe-CD44+CD25-CD117+ | córtex | Proliferación, perda de potenciais mieloides e B |
| Dobre negativo 2 | Liñaxe-CD44+CD25+CD117+ | córtex | - |
| Dobre negativo 3 | Liñaxe-CD44-CD25+ | córtex | Rearranxo do TCR-beta, selección beta |
| Dobre negativo 4 | Liñaxe-CD44-CD25- | córtex | - |
| Dobre positivo | CD4+CD8+ | córtex | Rearranxo do TCR-alfa, selección positiva, selección negativa |
| Simple positivo (positivo para un só marcador) | CD4+CD8- ou CD4-CD8+ | medula | Seleción negativa |
En humanos
[editar | editar a fonte]En humanos as células nais hematopoéticas CD34+ circulantes (HSC) residen na medula ósea. Producen precursores dos linfocitos T, que sementan o timo (converténdose así en timocitos) e diferéncianse baixo a influencia da proteína Notch e os seus ligandos.
Os timocitos dobre negativos iniciais expresan (e poden ser identificados por) CD2, CD5 e CD7. Aínda durante o estadio dobre negativo a expresión de CD34 cesa e exprésase CD1. A expresión á vez de CD4 e CD8 fainos ser dobres positivos e maduran en células de tipo CD4+ ou de tipo CD8+.[2]
Eventos durante a maduración
[editar | editar a fonte]| tipo: | funcional (selección beta) | funcional (selección positiva) | autorreactivo (selección negativa) |
| localización: | córtex | córtex | córtex/medula |
 |
Para pasar o punto de control da selección |
Para seren seleccionados positivamente, os timocitos terán que interaccionar con varias moléculas da superficie celular, as do complexo maior de histocompatibilidade (MHC), para asegurar a reactividade e a especificidade.[3] A selección positiva selecciona células cun receptor de células T capaz de unirse a moléculas do MHC de clase I e de clase II con polo menos unha afinidade débil. Isto elimina (por un proceso chamado "morte por ignorancia" clonal) aquelas células T que serían non funcionais debido á súa incapacidade de unirse ao MHC. |
A selección negativa é a indución activa da apoptose en timocitos con alta afinidade polos péptidos propios ou MHC. Isto elimina células que dirixirían respostas inmunitarias contra proteínas propias na periferia. A selección negativa non é efectiva ao 100% e algunhas células T autorreactivas escapan da censura tímica e libéranse na circulación. Hai mecanismos adicionais de tolerancia activa na periferia para silenciar estas células, como a anerxia, a deleción e as células T reguladoras. Se estes mecanismos de tolerancia periférica tamén fallan, pode orixinarse unha autoinmunidade. |
Establecemento no timo
[editar | editar a fonte]Os timocitos derivan en última instancia de células proxenitoras hematopoéticas da medula ósea [ver célula nai hematopoética, hematopoese] que chegan ao timo desde a circulación.[4] O número de proxenitoras que entran no timo cada día pénsase que é extremadamente pequeno. Por tanto, non se coñece que células proxenitoras colonizan o timo. Actualmente, propúxose que os proxenitores linfoides iniciais (ELP, Early Lymphoid Progenitors) se establecen no timo e probablemente son os precursores de polo menos algúns timocitos. Os ELPs son Liñaxe-CD44+CD25-CD117+, polo que lembran moito a ETPs, os proxenitores iniciais no timo. Os precursores entran no timo na zona de unión córtico-medular. Moléculas que se coñece que son importantes para a entrada no timo son a P-selectina (CD62P) e os receptores de quimocinas CCR7 e CCR9.[5]
Despois da entrada no timo, as células proxenitoras proliferan para xerar a poboación de ETPs. Este paso é seguido pola xeración de timocitos DN2, que migran desde a unión córtico-medular cara á cápsula do timo. Os timocitos DN3 xéranse na zona subcapsular.
Ademais da proliferación, a diferenciación, o compromiso coa liñaxe T ocorren na poboación de timocitos DN. O compromiso ou perda de potenciais de liñaxes alternativas (como os potenciais de liñaxes mieloide, B e NK), depende da sinalización de Notch e é completa no estadio DN3. Despois do compromiso coa liñaxe T, os timocitos DN3 sofren selección
Selección β
[editar | editar a fonte]
A habilidade das células T de recoñeceren antíxenos estraños está mediada polo receptor de células T (TCR), que é unha proteína de superficie que pode recoñecer secuencias curtas de proteínas (péptidos) que lle son presentadas sobre MHC. O propósito do desenvolvemento dos timocitos é producir células T maduras cun conxunto diverso de receptores de células T funcionais por medio dun proceso de rearranxo dos xenes dos TCR.
A diferenza da maioría dos xenes, que teñen unha secuencia estable en cada célula que os expresa, o receptor de células T está feito a partir dunha serie de fragmentos xénicos alternativos. Para crear un receptor de células T funcional, os timocitos dobre negativos utilizan unha serie de encimas que interaccionan co ADN e córtano e despois unen os fragmentos separados de xenes. O resultado deste proceso é que cada receptor de células T ten unha secuencia diferente, debido á diferente elección de fragmentos de xenes e aos erros introducidos durante o proceso de corte e unión (ver sección en recombinación V(D)J para máis información sobre o rearranxo TCR). A vantaxe evolutiva de ter un gran número de receptores de células T únicos é que a célula T pode recoñecer un péptido diferente, proporcionando unha defensa contra patóxenos que evolucionan rapidamente.[7]
O rearranxo do TCR ocorre en dúas etapas. Primeiro, rearránxase a cadea TCR
No estadio de selección
Despois da selección
Selección positiva e compromiso de liñaxe
[editar | editar a fonte]
Os timocitos que pasan a selección
Os timocitos dobre positivos que teñen un receptor de células T que poida unirse a MHC de clase I ou de clase II (mesmo con só unha feble afinidade) reciben sinalización a través do receptor de células T.[3] Os timocitos que teñen un receptor de células T incapaz de unirse a MHC de clase I ou de clase II sofren apoptose. Algúns timocitos poden rescatar a selección positiva fallida por edición do receptor (rearranxo do outro alelo do receptor de células T para producir un novo receptor de células T).
Os timocitos dobre positivos sofren o compromiso de liñaxe, madurando nunha célula T CD8+ (recoñecen a MHC de clase I) ou nunha célula T CD4+ (recoñecen a MHC de clase II). O establecemento do compromiso de liñaxe ocorre no estadio tardío da selección positiva e funciona por regulación á baixa de CD4 e CD8 (reducindo o sinal procedente do receptor de células T) e despois por regulación á alza de só CD4. Os timocitos que empezan recibindo o sinal outra vez son aqueles que recoñecen a MHC de clase II e convértense en células T CD4+. Os timocitos que non empezan recibindo o sinal outra vez son aqueles que recoñecen a MHC de clase I e regulan á baixa o CD4 e á alza o CD8, para converterse así en células T CD8+. Estes timocitos de ambos os tipos coñécense como timocitos simple positivos (positivos para un só antíxeno).
Selección negativa
[editar | editar a fonte]- Artigo principal: Tolerancia central.
O éxito na selección positiva permite que o timocito sufra varios cambios maduracionais durante a transición a célula T simple positiva. As células T simples positivas regulan á alza o receptor de quimocina CCR7, causando a migración desde o córtex á medula. Neste estadio o proceso clave da maduración é a selección negativa, é dicir, a eliminación de timocitos autorreactivos.
A desvantaxe fundamental nun proceso de rearranxo de xenes dos receptores das células T é que por puro azar, algúns arranxos de fragmentos de xenes crearán un receptor de célula T capaz de unirse a péptidos propios presentados sobre moléculas MHC de clase I ou de clase II. Se células T que levan estes receptores de células T entrasen na periferia, serían capaces de activar unha resposta inmunitaria contra o propio, orixinando como resultado unha autoinmunidade. A selección negativa é o proceso que evolucionou para reducir este risco. Durante a selección negativa, todos os timocitos cunha alta afinidade por unirse a péptidos propios presentados sobre MHC de clase I ou II son inducidos a regular á alza BCL2L11, a cal é unha proteína que conduce á apoptose. As células que non teñen unha alta afinidade por antíxenos propios sobreviven á selección negativa. Neste estadio, algunhas células son tamén seleccionadas para converterse en células T reguladoras, xeralmente células que teñen unha afinidade intermedia polos péptidos propios.
A selección negativa pode ocorrer no estadio dobre positivo no córtex. Porén, o repertorio de péptidos no córtex está limitado a aqueles que expresan as células epiteliais e as células dobre positivas apenas sofren selección negativa. Por tanto, o sitio máis importante para a selección negativa é a medula, unha vez que as células están no estadio simple positivo. Para eliminar timocitos reactivos a órganos periféricos, os factores de transcrición Aire e Fezf2 levan á expresión de múltiples antíxenos periféricos, como a insulina, o que ten como resultado a deleción de células específicas para eses antíxenos.[13][14] Isto permite que timocitos simple positivos sexan expostos a un conxunto máis complexo de autoantíxenos que o que está presente no córtex, e así elimínanse máis eficientemente as células T que son autorreactivas.
Os timocitos simple positivos permanecen na medula durante unha ou dúas semanas, inspeccionando os autoantíxenos para comprobar a autorreactividade. Durante este tempo experimentan os cambios maduracionais finais e despois saen do timo usando S1P e CCR7. Despois da entrada na circulación sanguínea periférica, as células son xa consideradas células T maduras e non timocitos.
A selección negativa non é efectiva ao 100%, e algunhas células T autorreactivas escapan da súa censura e son liberadas á circulación. Hai mecanismos adicionais de tolerancia periférica activos na periferia para silenciar estas células, como a anerxia, a delecióon e a acción das células T reguladoras. Se tamén fallan estes mecanismos de tolerancia periférica, pode orixinarse autoinmunidade.
O transplante de timo ten como resultado que ás células T se lles vai ensinar a evitar reaccionar con antíxenos do doante en vez de cos propios, polo que aínda van poder reaccionar con moitos autoantíxenos do corpo. As enfermidades autoinmunes son unha complicación frecuente despois do transplante de timo, observada no 42% dos suxeitos ata 1 ano despois do transplante.[15] Non obstante, isto explícase parcialmente porque a propia indicación, é dicir, a síndrome de DiGeorge completa (ausencia de timo), incrementa o risco de enfermidade autoinmune.[16]
Cancro
[editar | editar a fonte]Os timocitos que adquiren mutacións oncoxénicas que permiten a proliferación celular incontrolada poden orixinar linfomas tímicos.
Liñaxes alternativas
[editar | editar a fonte]Igual que as células T
Notas
[editar | editar a fonte]- ↑ Dorland's Medical Dictionary thymocyte
- ↑ Figura 12-13 en: Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson (2007). Robbins Basic Pathology. Philadelphia: Saunders. ISBN 978-1-4160-2973-1. 8ª edición.
- ↑ 3,0 3,1 Baldwin TA, Hogquist KA, Jameson SC (2004). "The fourth way? Harnessing aggressive tendencies in the thymus". J Immunol 173 (11): 6515–20. PMID 15557139. doi:10.4049/jimmunol.173.11.6515.
- ↑ Schwarz BA, Bhandoola A. Trafficking from the bone marrow to the thymus: a prerequisite for thymopoiesis. Immunol Rev 209:47, 2006. texto completo
- ↑ Schwarz BA, Sambandam A, Maillard I, Harman BC, Love PE, Bhandoola A. Selective thymus settling regulated by cytokine and chemokine receptors. J Immunol. 15 de febreiro de 2007;178(4):2008-17. [1]
- ↑ C. Clare Blackburn & Nancy R. Manley "Developing a new paradigm for thymus organogenesis" Nature Reviews Immunology. Abril de 2004. 278-289 Consultado o 10/4/12 [2]
- ↑ Sleckman BP, Lymphocyte antigen receptor gene assembly: multiple layers of regulation. Immunol Res 32:153-8, 2005. texto completo Arquivado 2008-01-27 en Wayback Machine.
- ↑ Allam, Amr H.; Charnley, Mirren; Pham, Kim; Russell, Sarah M. (2021-03-01). "Developing T cells form an immunological synapse for passage through the
β -selection checkpoint". Journal of Cell Biology (en inglés) 220 (3): e201908108. ISSN 0021-9525. PMC 7814350. PMID 33464309. doi:10.1083/jcb.201908108. - ↑ Irving, Bryan A.; Alt, Frederick W.; Killeen, Nigel (1998-05-08). "Thymocyte Development in the Absence of Pre-T Cell Receptor Extracellular Immunoglobulin Domains". Science (en inglés) 280 (5365): 905–908. Bibcode:1998Sci...280..905I. ISSN 0036-8075. PMID 9572735. doi:10.1126/science.280.5365.905.
- ↑ Koller, Beverly H.; Marrack, Philippa; Kappler, John W.; Smithies, Oliver (2010-05-01). "Normal development of mice deficient in beta 2M, MHC class I proteins, and CD8+ T cells. 1990". Journal of Immunology 184 (9): 4592–4595. ISSN 1550-6606. PMID 20410496.
- ↑ Mizsei, Réka; Li, Xiaolong; Chen, Wan-Na; Szabo, Monika; Wang, Jia-huai; Wagner, Gerhard; Reinherz, Ellis L.; Mallis, Robert J. (xaneiro de 2021). "A general chemical crosslinking strategy for structural analyses of weakly interacting proteins applied to preTCR-pMHC complexes". Journal of Biological Chemistry 296: 100255. ISSN 0021-9258. PMC 7948749. PMID 33837736. doi:10.1016/j.jbc.2021.100255.
- ↑ Li, Xiaolong; Mizsei, Réka; Tan, Kemin; Mallis, Robert J.; Duke-Cohan, Jonathan S.; Akitsu, Aoi; Tetteh, Paul W.; Dubey, Abhinav; Hwang, Wonmuk; Wagner, Gerhard; Lang, Matthew J. (2021-01-08). "Pre–T cell receptors topologically sample self-ligands during thymocyte
β -selection". Science (en inglés) 371 (6525): 181–185. Bibcode:2021Sci...371..181L. ISSN 0036-8075. PMC 8011828. PMID 33335016. doi:10.1126/science.abe0918. - ↑ Anderson, M.S. et al. (2002) Projection of an Immunological Self-Shadow Within the Thymus by the Aire Protein. Science 298 (5597), 1395-1401
- ↑ Takaba, H. et al. (2015) Fezf2 Orchestrates a Thymic Programs of Self-Antigen Expression for Immune Tolerance. Cell 163, 975 - 987
- ↑ Thymus Transplantation Book. Thymus Gland Pathology, pages 255-267, Springer Milan 2008 doi 10.1007/978-88-470-0828-1 ISBN 978-88-470-0827-4 (impreso) ISBN 978-88-470-0828-1 (on line) doi 10.1007/978-88-470-0828-1_30
- ↑ Markert ML, Devlin BH, Alexieff MJ, et al. (maio de 2007). "Review of 54 patients with complete DiGeorge anomaly enrolled in protocols for thymus transplantation: outcome of 44 consecutive transplants". Blood 109 (10): 4539–47. PMC 1885498. PMID 17284531. doi:10.1182/blood-2006-10-048652.
- ↑ van den Brandt J, Voss K, Schott M, Hünig T, Wolfe MS, Reichardt HM (maio de 2004). "Inhibition of Notch signaling biases rat thymocyte development towards the NK cell lineage". Eur. J. Immunol. 34 (5): 1405–13. PMID 15114674. doi:10.1002/eji.200324735.
- ↑ Sánchez MJ, Spits H, Lanier LL, Phillips JH (decembro de 1993). "Human natural killer cell committed thymocytes and their relation to the T cell lineage". J. Exp. Med. 178 (6): 1857–66. PMC 2191276. PMID 7504051. doi:10.1084/jem.178.6.1857.
- ↑ Geraldo A. Passos Cesar A. Speck‐Hernandez Amanda F. Assis Daniella A. Mendes‐da‐Cruz. "Update on Aire and thymic negative selection".
