כתיב כימי

כתיב כימי הוא אוסף של כללים ומוסכמות בהם משתמשים בכימיה לתיאור אטומים, מולקולות, מבנים כימיים אחרים, תגובות כימיות ומנגנונים של תגובות כימיות.
אטומים
[עריכת קוד מקור | עריכה]כל אטום מיוצג על ידי אוסף של סימנים המבטא את התכונות העיקריות של האטום. סימנים אלו כוללים:
- סמל כימי - הסמל מורכב מאחת או יותר אותיות לטיניות המהוות את קיצור שמו של היסוד, במקרים רבים בלטינית. האות הראשונה תמיד גדולה, והאותיות הבאות, אם ישנן, הן קטנות. להלן מספר דוגמאות:
| שם היסוד | הסמל הכימי | מקור הסמל |
|---|---|---|
| מימן | H | מלטינית: Hydrogenium |
| כסף | Ag | מלטינית: Argentum |
| טנטלום | Ta | על שם טנטלוס מהמיתולוגיה היוונית |
| כספית | Hg | מלטינית: Hydragyrum |
| איטרביום | Yb | על שם הכפר איטרבי (Ytterby) במחוז סטוקהולם, שוודיה |
במקרים מסוימים מציינים אחד או יותר מהנתונים הבאים בנוסף לסמל הכימי עצמו:
- מספר מסה - מופיע בכתב עילי משמאל לסמל הכימי, ומציין את הכמות הכוללת של הנוקליאונים (הפרוטונים והנייטרונים) הנמצאים בגרעין האטום. את מספר המסה מציינים כשיש צורך להדגיש את סוג האיזוטופ. לדוגמה:
- מספר אטומי - מופיע בכתב תחתי משמאל לסמל היסוד, ומציין את מספר הפרוטונים בגרעין האטום. מספר הפרוטונים של היסוד קובע את מיקומו הסידורי של היסוד בטבלה המחזורית:
- (אטום פחמן. מספרו האטומי 6).
בטבלה המחזורית נהוג במקרים רבים לציין את מספר המסה ואת המספר האטומי יחד:
- אלקטרוני הערכיות - האלקטרונים הנמצאים ברמת האנרגיה האחרונה מסומנים כנקודות מסביב לסמל הכימי של היסוד.
- המטען החשמלי - כשיש הבדל בין מספר הפרוטונים למספר האלקטרונים באטום מוסיפים לסמל הכימי של היסוד סימון המייצג את ההפרש בין המספרים. הסימון, המופיע בכתב עילי מימין לסמל היסוד, מכיל את הסימן + כשיש יותר פרוטונים או את הסימן - אם מספר האלקטרונים גדול יותר. כאשר ההפרש גדול מ-1 מוסיפים מספר המייצג את ההפרש מצד שמאל של הסימן.
תרכובות: נוסחאות טקסט
[עריכת קוד מקור | עריכה]- נוסחה מולקולרית היא הדרך הבסיסית ביותר לציון תרכובות. בנוסחה זו נכתבים הסמלים הכימיים של האטומים המרכיבים אותה, ולצידם מספר האטומים מכל סוג. מספר האטומים נכתב מימין לסמל הכימי, בכתב תחתי. ישנם שני סוגי כתיבה, נוסחה אמפירית ונוסחה מולקולרית.
- בכתיבת נוסחה אמפירית נכתבים בתחילה (בצד שמאל) אטומי המתכות ולאחר מכן אטומי האל-מתכות. בין אטומי האלמתכת ייכתב קודם הפחמן (סימונו C), לאחר מכן מימן (H) ולאחריו החמצן (O). אטומים אחרים, אם קיימים בתרכובת ייכתבו, לרוב, על פי סדר הופעתם בטבלה המחזורית.
- לעומתה, בנוסחה מולקולרית יופיעו האטומים על פי מיקומם וקישורם במולקולה. כתיבה זו מסובכת יותר, שכן היא דורשת מידע לגבי המבנה המולקולרי של המולקולה.
- דוגמאות:
- (מולקולת מים; מורכבת משני אטומי מימן ואטום חמצן אחד. המימן נכתב תחילה והחמצן אחריו).
- (מולקולת נתרן הידרוקסידי; מורכבת מאטום נתרן, אטום חמצן ואטום מימן. הכתיבה היא של נוסחה מולקולרית, ולכן החמצן מופיע לפני המימן).
- (תרכובת אורגנית לדוגמה; ראו פירוט בהמשך).
- נוסחה אמפירית של תרכובת מראה את היחסים המספריים בין האטומים השונים בתרכובת, זאת בניגוד לנוסחה המולקולרית, המראה את המספרים האבסולוטיים של האטומים. בנוסחאות אמפיריות משתמשים בעיקר בחישובים סטויכיומטריים ולא בכתיב כימי כללי:
- (נוסחה אמפירית של מימן על-חמצני; הנוסחה מראה יחס של 1:1 בין מספר אטומי המימן והחמצן במולקולה).
- (נוסחה מולקולרית של מימן על-חמצני; הנוסחה מראה את המספר האמיתי והמוחלט של האטומים במולקולה).
- נוסחת מבנה מציינת את מספרם של כל אטומי התרכובת, בדומה לנוסחה מולקולרית, אך ממחישה במידה זו או אחרת את האופן שבו האטומים מסודרים במולקולה. לשם כך ניתן לכתוב בנוסחאות מבנה את אותו האטום יותר מפעם אחת; באופן זה מתחלקת התרכובת בנוסחת המבנה למעין "תתי-קבוצות" המקלות על הבנת המבנה הסידורי של האטומים במולקולה.
- נוסחאות מבנה נפוצות במיוחד בכימיה האורגנית ומקלות על הצגתם של שרשראות פחמימניות ושל קבוצות פונקציונליות. בנוסף, נוסחאות מבנה מאפשרות הבדלה בין איזומרים מבניים—תרכובות שונות הנבדלות זו מזו אך ורק באופן שבו האטומים שלהן קשורים זה לזה (מספר האטומים מכל סוג זהה בשתי התרכובות). נוסחה מולקולרית אינה מאפשרת הבדלה בין איזומרים מבניים.
- קיימות רמות שונות של פירוט של נוסחאות מבנה, והבחירה ברמת הפירוט תלויה בחשיבות מבנה התרכובת לנושא המדובר וברמת הידע המשוערת של הקוראים. להלן מספר דוגמאות:
- (נוסחה מולקולרית של אתנול ושל דימתיל אתר, איזומרים מבניים).
- (נוסחת מבנה מפורטת יותר של אתנול. הנוסחה מפרידה בין כל אטומי הפחמן בתרכובת, ומראה בבירור שאתנול מורכב מקבוצת מתיל, קבוצת מתילן וקבוצת הידרוקסיל).
- (נוסחת מבנה של דימתיל אתר. אטום החמצן נכתב במרכז הנוסחה, דבר המבהיר כי מדובר באתר).
- קבוצות במולקולה המופיעות מספר פעמים ניתן לייצג בנוסחת המבנה באמצעות סוגריים:
- (נוסחת מבנה של פנטנול. המולקולה מורכבת מקבוצת מתיל, ארבע קבוצות מתילן וקבוצת הידרוקסיל).
קשרים קוולנטיים: מבנה לואיס
[עריכת קוד מקור | עריכה]- במבנה לואיס מיוצגים האלקטרונים במולקולה—רק אלו שבקליפת הערכיות—באמצעות נקודות. לשם המחשה מלאה מיוצגים כל האלקטרונים בקליפה הערכיות, אלו המשתתפים בקשרים קוולנטיים ואלו שאינם קשורים. בדרך כלל המחשה זו אינה נחוצה; במקרה זה מסתפקים באלקטרונים הקושרים בלבד.
- ברוב המקרים ניתן לייצג קשרים קוולנטיים בנוסחאות מבנה באמצעות קווים במקום נקודות: קו בודד לקשר בודד, קו כפול לקשר כפול וקו משולש לקשר משולש. לרוב קשרים של אטומי מימן אינם מיוצגים. בדרך כלל נמנעים מייצוג הקשרים אם אין בכך צורך ממשי, אך במקרים רבים תורם ייצוג הקשרים רבות להבנת מבנה התרכובת. נוסחאות המבנה העושות שימוש בקווים, וכן נוסחאות הקו (ראו בהמשך) נחשבות כווריאציות של מבני לואיס:
- (נוסחת מבנה של פרופאן עם ייצוג הקשרים הקוולנטיים בין אטומי הפחמן. כיתוב זה מיותר ברוב המקרים, שכן מנוסחת המבנה הפשוטה של פרופאן, CH3CH2CH3, ניתן להסיק בקלות את קיום הקשרים הבודדים).
- (נוסחת מבנה של אתן).
- (נוסחת מבנה של 1,3-בוטאדיאֵן. ייצוג הקשרים תורם במקרה זה באופן משמעותי להבנת מבנה המולקולה).
- גם זוג אלקטרונים בלתי-קושרים ניתן לייצוג באמצעות קו. להלן נוסחת לואיס של פחמן דו-חמצני, בה מיוצגים שני קשרים כפולים באמצעות קווים כפולים, וכן שני זוגות אלקטרונים בלתי-קושרים בכל אטום חמצן:

- נוסחאות מבנה מוגבלות בעיקר למולקולות הבנויות משרשרת פשוטה ובלתי-מסועפת. למרות זאת ניתן להציג במולקולות קטנות הסתעפויות. להלן נוסחת מבנה מורחבת של התרכובת 5-מתיל-2-הקסאנון:
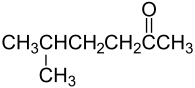
תרכובות: יונים, קשרים קוטביים, פולימרים
[עריכת קוד מקור | עריכה]- יון הוא אטום או מולקולה בעלי מטען חשמלי. המטען החשמלי של היון מיוצג באמצעות סימן פלוס (+, מטען חיובי=קטיון) או סימן מינוס (-, מטען שלילי=אניון). הסימן נכתב מימין ליון ובכתב עילי. גם ביונים המורכבים ממספר אטומים נכתב הסימן מימין ליון; הסימן מציין את מטענו הכולל של היון ואינו מציין שהמטען שוכן על האטום הימני ביותר.
- המטען החשמלי של יונים מציין את מאזן האלקטרונים והפרוטונים ביון. למשל, יון שבו מספר הפרוטונים גדול ב-3 ממספר האלקטרונים מטען חיובי משולש. מספרו של המטען מצוין משמאל לסימן המטען, גם כן בכתיב עילי.
להלן מספר דוגמאות:
- (יון נתרן בעל מטען חיובי בודד).
- (יון גופרי (סולפיד) בעל מטען שלילי כפול).
- קשר קוטבי הוא קשר קוולנטי בין שני אטומים בעלי אלקטרושליליות שונה. האטום האלקטרושלילי יותר מושך אליו את אלקטרוני הקשר וכתוצאה מכך הופך לבעל מטען חשמלי חלקי שלילי. האטום השני הופך לבעל מטען חשמלי חלקי חיובי. בקשר קוטבי המטענים הם חלקיים, ואינם מקבילים למטענים המלאים ביונים. כדי לציין מטען חלקי משתמשים באות היוונית הקטנה דלתא (
δ ) ובסימן פלוס או מינוס. את המטענים החלקיים מציינים אך ורק אם הדבר רלוונטי, במנגנון תגובה למשל (ראו למטה). את סימול המטען החלקי ניתן למקם בכל מקום שהוא לצד האטום הרלוונטי. בדוגמה הבאה מוצגת מולקולת מימן כלורי. לכלור האלקטרושלילי מטען חלקי שלילי, ולמימן מטען חלקי חיובי:
- פולימר הוא מולקולה ארוכה המורכבת מיחידות זהות רבות (מונומרים) הקשורות האחת לשנייה. בכתיבת פולימרים מספיק לתאר את יחידת המונומר פעם אחת בלבד כשהיא מוקפת בסוגריים (בדרך כלל מרובעות) עם ציון האות n בצד הימני התחתון, לציון מספר בלתי-ידוע ובלתי-מוגבל של יחידות. להלן, מימין, נוסחת המבנה של הפולימר פוליאקרילוניטריל, ומשמאל נוסחת הקו (ראו בהמשך) של פוליפאראפנילן:
 |
 |
 |
תרכובות: נוסחאות קו
[עריכת קוד מקור | עריכה]נוסחאות קו נפוצות מאוד בכימיה אורגנית. נוסחאות הקו חוסכות מקום ועומס של סמלים, והן מתאפשרות עקב העובדה שכל התרכובות האורגניות בנויות משלד של אטומי פחמן הקשורים אחד לשני ולאטומי מימן. לפיכך, מושמטים אטומי הפחמן והמימן בנוסחאות הקו, כיוון שקיומם ברור מאליו. אטומים אחרים (חמצן וחנקן, למשל) מוצגים תמיד. הצגת אטומי הפחמן והמימן גמישה, ולעיתים הם מוצגים לשם הבהרה והדגשה.
בנוסחאות הקו מיוצגים הקשרים שבין אטומים הפחמן השונים ובין אטומי פחמן ואטומים אחרים (חוץ ממימן) באמצעות קווים ישרים. אטומי הפחמן עצמם אינם נכתבים, כאמור; כל קצה של קו מייצג אטום פחמן. אטומי המימן אינם מוצגים כלל (ואף הקשרים שלהם אינם מוצגים), וקיומם מוסק מספירת הקשרים של אטומי הפחמן. אטום פחמן מסוגל ליצור ארבעה קשרים קוולנטיים; לפיכך, לאטום פחמן הקשור בקשר בודד לאטום פחמן אחר נותרים שלושה קשרים, אשר מוקדשים בהכרח (אלא אם מצוין אחרת) לקשירת שלושה אטומי מימן.
כך, למשל, קו שבור מייצג מולקולת פרופאן (CH3—CH2—CH3). כל קצה של קו, כולל השבירה באמצע המולקולה, מייצג אטום פחמן; שני אטומי הפחמן שבקצוות קשורים לאטום פחמן אחד נוסף, כך שבאפשרותם לקשור שלושה אטומי מימן. אטום הפחמן האמצעי, לעומת זאת, קשור לשני אטומי פחמן, כך שנותרים לו רק שני קשרים לקשירת אטומי מימן. מימין מוצגת נוסחת הקו המקוצרת של פרופאן, ומשמאל נוסחת המבנה המלאה:
 |
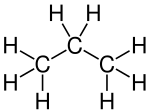 |
- קשרים כפולים ומשולשים מיוצגים באמצעות קו כפול או משולש, בהתאמה. מעבר פתאומי בין קשר משולש לקשר בודד, למשל, מצביע על אטום פחמן הקיים בין שני הקשרים. ניתן לראות זאת בנוסחה הקווית של מולקולת פרופין (CH3—C≡CH):

- בדוגמה הבאה ארבע דרכים שונות לייצוג מולקולת פירימידין. מימין מוצג מודל כדורי של המולקולה. משמאל מוצגות שלוש נוסחאות קוויות ברמות פירוט שונות. שתי הנוסחאות האמצעיות זהות, למעשה, ומהוות שתי דרכים שונות לייצוג טבעת ארומטית:

- אף את המבנה המרחבי של תרכובת ניתן להציג, במידה מסוימת, באמצעות נוסחאות קו, זאת באמצעות סימון קשרים קוולנטיים אשר בולטים אל מעל למשטח הדף או הצג, לכיוון הקורא (סימון הקשר באמצעות משולש מודגש), ולצידם קשרים אשר חודרים אל משטח הדף או הצג, בכיוון המנוגד לקורא (סימון באמצעות משולש או קו מקווקו). בדוגמה הבאה, של נוסחת הקו של תרופת ה-SSRI אסקיטאלופרם, ניתן לראות דוגמה אחת לכל אחד מהקשרים הללו במרכז המולקולה:
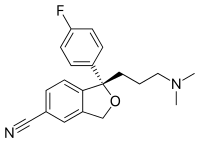
- בדוגמה הבאה מוצגים שני סטריאואיזומרים של הסם הפסיכואקטיבי אמפטמין. באיזומר הימני קבוצת המתיל (CH3) חודרת אל משטח הצג (קו מקווקו), ובאיזומר האמצעי קבוצת המתיל בולטת מעל למשטח הצג (משולש עבה). תערובת רצמית היא תערובת המורכבת מכמויות שוות של שני האיזומרים; לייצוג תערובת רצמית בנוסחאות קו משתמשים בקו גלי (המולקולה השמאלית):
 |
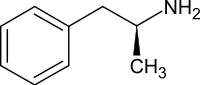 |
 |
- קשרים בין-מולקולריים - קשרים חלשים יחסית המתקיימים בין מולקולות שונות. בנוסחאות קו מיוצגים קשרים בין-מולקולריים באמצעות קו מקווקו. בדוגמה הבאה מוצגים קשרי מימן בין שתי שרשראות של הפולימר קבלר:

תרכובות אורגניות: היטלים מיוחדים
[עריכת קוד מקור | עריכה]- היטל פישר הוא דרך לתיאור גרפי של תרכובות אורגניות, המפשטת את ההצגה התלת-ממדית של האטומים במרחב. בהיטל פישר קיימים קשרים מאונכים ואופקיים בלבד (כשביניהם זוויות ישרות). הקווים האופקיים מייצגים אטומים שבולטים קדימה, כלפי הצופה, ואילו הקווים המאונכים - כיוונם אחורה, לתוך הדף. מפגש בין שני קווים מייצג אטום פחמן, כמו בנוסחת קו. היטלי פישר שימושיים מאוד בהבחנה בין שני האננטיומרים של מולקולה כיראלית; הם משמשים לעיתים קרובות לתיאור פחמימות, היות שפחמימות רבות נבדלות האחת מהשנייה במיקומו המרחבי של אטום או קבוצה אחת בלבד (גלוקוז וגלקטוז, למשל), ודרכי תצוגה אחרות מקשות על הבחנה מהירה בין הפחמימות השונות. להלן היטל פישר של גלוקוז (מימין), והדרך בה יש להמיר מולקולה המצוירת בנוסחת קו להיטל פישר:
 |
 |
- היטל ניומן משמש בעיקר לתיאור הסיבוב במרחב של קשרים קוולנטיים בודדים בין שני אטומי פחמן. קשרים אלו, בניגוד לקשרים כפולים או משולשים, אינם קשיחים ומאפשרים סיבוב מלא סביב ציר הקשר. בנוסחה רגילה מוצג קשר באופן אופקי (אטום אחד מימין, האטום השני משמאל, וביניהם קו). בהיטל ניומן מוצג הקשר באופן אנכי, כשאטום אחד נמצא מקדימה (קרוב לעין הצופה) והאטום השני בדיוק מאחוריו, הרחק מעין הצופה; הקשר עצמו אינו מיוצג כלל. האטום הקרוב מיוצג כנקודה (מפגש בין קווים המייצגים מתמירים), ואילו האטום המרוחק מיוצג על ידי מעגל. היטלי ניומן משמשים בעיקר להצגת אלקאנים ונגזרותיהם (תרכובות בעלות קשרים בודדים). בדוגמה שלהלן מוצג היטל ניומן של אתנול (מימין) והדרך בה ממירים נוסחת קו (משמאל) להיטל ניומן:

תגובות כימיות
[עריכת קוד מקור | עריכה]- בתגובה כימית מוצג השינוי שחל במגיבים ואשר הוביל ליצירת התוצרים. שלבי הביניים, אם ישנם, אינם מוצגים. בין המגיבים והתוצרים מוצג חץ אופקי המציין את התרחשות התגובה ואת המעבר מהמגיבים (משמאל לחץ) אל התוצרים (מימין לחץ). דוגמאות:
- (תגובה בין יון נתרן ויון כלור לקבלת נתרן כלורי).
- (תגובה בין מימן כלורי ומים לקבלת יון הידרוניום ויון כלוריד).
- בכתיב כימי רשמי יש לציין את מצב הצבירה של כל תרכובת במגיבים ובתוצרים. דבר זה נהוג בעיקר בכימיה אי-אורגנית. מצב הצבירה נכתב בכתב תחתי, בתוך סוגריים, מימין לתרכובת. מצבי הצבירה הם (g) עבור גז, (l) עבור נוזל, (s) עבור מוצק. תרכובות המומסות במים מצוינות באמצעות הסימול (aq). בתמיסות בעלות ממס שאינו מים ניתן לציין בסוגריים את הממס, לדוגמה (EtOH) עבור אתנול:
- (תגובה בין יון נתרן ויון כלור לקבלת נתרן כלורי).
- משמאל לכל מגיב ותוצר נכתב מספר המולים היחסי, אלא אם כן המספר הוא אחד (1). ניתן להשתמש גם בשברים (½, למשל) לציון מספר המולים:
- (תגובה בין שתי מולקולות דו-אטומיות של מימן ומולקולה אחת של חמצן לקבלת מים).
- כלל בסיסי בכימיה הוא איזון משוואת התגובה הכימית; מספר האטומים מכל יסוד המופיעים מצדו השמאלי של החץ מוכרח להיות שווה למספר האטומים בצדו הימני של החץ. כלל זה משקף את העיקרון שכמות החומר ביקום קבועה ושחומר אינו מסוגל "ללכת לאיבוד". למרות זאת, בכימיה האורגנית, ובמיוחד בביוכימיה, לא חלה תמיד הקפדה יתרה על איזון משוואת התגובה. הדבר נועד למנוע סרבול; מולקולות קטנות אשר משתתפות בתהליך אך אשר חשיבותן לתגובה עצמה שולית מושמטות במקרים רבים ממשוואת התגובה.
- לתנאי התגובה חשיבות עליונה בכימיה. תגובה המתרחשת בטמפרטורה נמוכה, למשל, עשויה להניב תוצרים שונים לגמרי מאותם המגיבים לו הייתה התגובה מתרחשת בטמפרטורה גבוהה. את תנאי התגובה נהוג לכתוב מעל לחץ התגובה. תנאים נפוצים הם טמפרטורה, חשיפה לאור או מניעת אור, חשיפה לקרינה והפעלת לחץ מכני.
- תגובות רבות מתרחשות בנוכחות זרזים; גם אותם יש לכתוב מעל לחץ התגובה. זרזים יכולים להיות מתכות (פלטינה או אירידיום, למשל), אנזימים או מולקולות אחרות, כגון מים או אמוניה. תגובות רבות מזורזות על ידי חומצות או בסיסים בלבד; גם תנאי זה ניתן לכתיבה מעל לחץ התגובה (+H מציין סביבה חומצית, -OH מציין סביבה בסיסית).
- אופן כתיבת תנאי התגובה גמיש למדי; ניתן להשתמש בקיצורים מדעיים מקובלים, וניתן גם לכתוב באופן מילולי (רצוי באנגלית, אך למטרות לימוד ניתן לכתוב בכל שפה שהיא).
- התגובה הבאה, בין בנזאלדהיד (משמאל) ואצטופנון, מתרחשת רק בנוכחות בסיס (base באנגלית):

- התגובה הבאה מתרחשת לאחר חימום בן שעתיים לטמפרטורה של 85 מעלות צלזיוס:

- אם התגובה הפיכה יופיעו חיצים לשני הכיוונים המסמל שהתגובה לא תתרחש עד תום אלא עד לשיווי משקל, ואם אחת מהתגובות חזקה יותר מהשנייה התגובה החזקה תסומן בחץ גדול יותר.
מנגנוני תגובה
[עריכת קוד מקור | עריכה]- מנגנוני תגובה נפוצים במיוחד בכימיה אורגנית. התגובה, המוצגת בקיצור כמשוואה אחת, כפי שהוסבר לעיל, מפורקת לשלביה השונים. כל שינוי בקשרים שבין האטומים מוצג בשלב נפרד. האלקטרונים הבלתי-קשורים מוצגים כנקודות, וחיצים מראים את תנועת האלקטרונים ממקום למקום. להלן דוגמה למנגנון תגובה בין אמין ובין קטון. החץ האדום (הצבע להמחשה בלבד) מראה מעבר של זוג אלקטרונים ("התקפה") מאטום חנקן לאטום פחמן. בלשון הכימית נאמר כי אטום החנקן (וליתר דיוק: זוג האלקטרונים הבלתי-קשור של אטום החנקן) מתקיף את אטום הפחמן:

- בתגובה שלעיל מוצג חץ רגיל (סימטרי), אשר מציין מעבר של זוג אלקטרונים. בתגובות רדיקליות מתרחש מעבר של אלקטרון בודד מאטום לאטום. מעבר זה מיוצג באמצעות חץ בלתי-סימטרי. בדוגמה הבאה מוצגת סגירה של מולקולה קווית לטבעת. המולקולה הקווית היא רדיקל (כיוון שמוצג בה אלקטרון בודד). האלקטרון הבודד מתקיף את הקשר הכפול בקצה המולקולה (החץ העליון); כתוצאה מכך ניתק הקשר הכפול ואלקטרון בודד עובר מהקשר הכפול אל אטום הפחמן שבקצהו (החץ התחתון). המולקולה החדשה מהווה אף היא רדיקל, אלא שהאלקטרון הבודד שינה מקום:
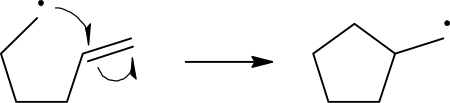
חיצים
[עריכת קוד מקור | עריכה]כחלק מהסימונים בכימיה, חיצים משמשים להסבר מעבר שונה בהתאם לסוג החץ.
- חץ עגול עם ראש מלא מסמל מעבר זוג אלקטרונים. זנב החץ תמיד יתחיל ממיקום זוג האלקטרונים וראש החץ יהווה את מיקומם החדש של האלקטרונים. דוגמה כזו קיימת בחלק 2 במנגנון התגובה הראשון (החץ האדום)

- חץ עגול עם חצי ראש מסמל מעבר אלקטרון בודד. זנב החץ תמיד יתחיל ממיקום האלקטרון/ הקשר הכפול וראש החץ יהווה את מיקומו החדש של האלקטרון. לרוב משתמשים בחץ מסוג זה במנגנוני תגובה של תגובות רדיקליות, בהן משתתף אלקטרון בודד. דוגמה לסימון כזה קיימת על המגיב במנגנון התגובה השני.

- חץ דו כיווני מסמל מצב של שיווי משקל רזונטיבי. בכימיה אורגנית נהוג לרשום את כל המבנים הרזונטיביים בתוך סוגריים מרובעים. במקום לשרטט את כל המבנים האפשריים, ניתן גם לשרטט קו נוסף מקווקו (החלק הימני בתמונה).

- חץ "רגיל" מראה את כיוון התגובה. נהוג לכתוב מעל ומתחת לחץ פרטים מיוחדים של התגובה, למשל טמפרטורה ייחודית, הוספת קטליזטור ועוד.

- שני חיצים מלאים בכיוונים מנוגדים מסמלים תגובה שמתרחשת לשני הכיוונים, כלומר שהתגובה לא מתרחשת ב-100% מהמגיבים או שהיא בשיווי משקל קינטי. אורך שונה של אחד החיצים מסמל העדפה לכיוון מסוים של התגובה.

- שני חיצים מנוגדים עם ראש חצוי מסמלים תגובה בשיווי משקל תרמודינמי. אורך שונה של אחד החיצים מסמל העדפה לכיוון מסוים של התגובה.

ראו גם
[עריכת קוד מקור | עריכה]קישורים חיצוניים
[עריכת קוד מקור | עריכה]- כתיב כימי, באתר אנציקלופדיה בריטניקה (באנגלית)

























