आर्सेनिक
| आर्सेनिक / Arsenic रासायनिक तत्व | |
 | |
| रासायनिक चिन्ह: | As |
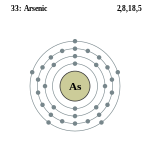
| परमाणु संख्या: | 33 |
| रासायनिक शृंखला: | उपधातुएँ |
 आवर्त सारणी में स्थिति
| |
 | |
| अन्य भाषाओं में नाम: | Arsenic (अंग्रेज़ी), Мышьяк (रूसी), |
आर्सेनिक, आवर्त सारणी के पंचम मुख्य समूह का एक रासायनिक तत्व है। इसकी स्थिति फास्फोरस के नीचे तथा एंटीमनी के ऊपर है। आर्सेनिक में अधातु के गुण अधिक और धातु के गुण कम विद्यमान हैं। इस धातु को उपधातु (मेटालॉयड) की श्रेणी में रखा जाता है। आर्सेनिक से नीचे एंटीमनी में धातुगुण अधिक हैं तथा उससे नीचे बिस्मथ पूर्णरूपेण धातु है। पंचम मुख्य समूह में नीचे उतरने पर धातुगुण में वृद्धि होती है।
आर्सैनिक की कुछ विशेषताएं निम्नांकित हैं :
- संकेत : As
- परमाणु क्रमांक : ३३
- परमाणु भार : ७४.९६
- आयन का अर्धव्यास : ०.६९ x १०-८ सेंटीमीटर
- गलनांक : ८२०° सेंटीग्रेड (३६ वायुमंडल दाब पर)
- विद्युत्प्रतिरोधकता : ३.५ x १०-५ (ओम-सेंटीमीटर , २०° सें. पर)
इतिहास
[संपादित करें]आर्सेनिक सल्फाइड का पता बहुत पहले लग चुका था। कौटिल्य ने अपने 'अर्थशास्त्र' में इसका वर्णन किया है। उसमें इस अयस्क का नाम हरिताल है। प्राचीन काल में इसका उपयोग हस्तलिखित पुस्तकों में अशुद्ध लेख को मिटाने के लिए किया जाता था। यूनानियों ने आर्सेनिक सल्फाइड का अध्ययन ईसवी से चौथी शताब्दी पूर्व किया। १३वीं शताब्दी में प्रसिद्ध कार्यकर्ता ऐलबर्टस मैगनस ने सल्फाइड अयस्क को साबुन के साथ गर्म करके एक धातु से मिलता जुलता पदार्थ बनाया। सन् १७३३ ई. में ब्रैंट ने यह सिद्ध किया कि आर्सेनिक एक तत्त्व है। सन् १८१७ ई. में स्वीडन देश के प्रसिद्ध वैज्ञानिक बर्जीलियस ने इसका परमाणु भार निकाला।
उपस्थिति
[संपादित करें]यौगिक अवस्था में आर्सेनिक पृथ्वी पर अनेक स्थानों में पाया जाता है। ज्वालामुखी के वाष्पों में, समुद्र तथा अनेक खनिजीय जलों में यह मिश्रित रहता है। आर्सेनिक के मुख्य अयस्क आक्साइड तथा सल्फाइड हैं। कहीं-कहीं यह तत्त्व अन्य धातुओं के साथ यौगिक रूप में मिलता है, मुख्यत: सिल्वर, एंटीमनी, ताम्र, लौह और कोबाल्ट के साथ आर्सेनिक यौगिक बनाता है।
गुणधर्म
[संपादित करें]साधारण ताप पर आर्सेनिक के दो भिन्न-भिन्न अपर रूप होते हैं, एक धूसर रंग का आर्सेनिक तथा दूसरा पीला आर्सेनिक।
धूसर रंग का आर्सेनिक अपारदर्शी है। इसके क्रिस्टल षट्कोणीय, कठोर, भंगुर तथा धातु की चमक लिए होते हैं। इसका आपेक्षिक घनत्व ५.७ है। यह आर्सेनिक तत्त्व का स्थायी रूप है।
पीला आर्सेनिक पारदर्शी होता है। इसके मणिभ घनाकार तथा नम्र होते हैं। इसका आपेक्षिक घनत्व २.० है। यह अस्थायी अपर रूप है। कार्बन द्विसल्फाइड में आर्सैनिक विलयन से पीला आर्सेनिक मणिभीकृत किया जाता है। पीले अपर रूप को गर्म करने या प्रकाश में रखने से वह धूसर रूप में परिणत हो जाता है। कुछ उत्प्रेरक पील अपर रूप को भूरे अपर रूप में परिवर्तित कर देते हैं।
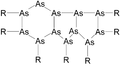
आर्सेनिक के अणु ८००° सेंटीग्रेड तक As-4 तथा तथा १७००° सेंटीग्रेड पर As-2 रूप में मिलते हैं।
आर्सेनिक तत्त्व में उपचायक (आक्सिडाइज़िंग) तथा अपचायक (रिड्यूसिंग) दोनों ही गुण विद्यमान हैं। यह ऑक्सीजन, फ्लोरीन, क्लोरीन, ब्रोमीन, आयोडीन, गंधक, पोटैसियम क्लोरेट तथा नाइटेट द्वारा उपचयित (आक्सीकृत) हो जाता है। इसके विपरीत सोडियम, पोटैसियम तथा अन्य क्षारीय धातुएँ आर्सेनिक को उपचयित करती हैं। जिन अवस्थाओं में वह यौगिक बनाता है उनके अनुसार आर्सेनिक की दो, तीन तथा पांच संयोजकताएँ हैं, हाइड्रोजन के साथ आरहा३ यौगिक बनता है, जो साधारण ताप पर गैसीय, रंगहीन, विषैला तथा अस्थायी होता है। आर्सेनिक हाइड्राइड एक शक्तिशाली अपचायक है। यह ताप या प्रकाश द्वारा विघटित हो जाता है।
क्षार, क्षारीय मृदाएँ (ऐल्कैलाइन अर्थ्स) तथा कुछ अन्य धातुएँ जैसे यशद, एल्यूमीनियम आदि आर्सेनिक के साथ यौगिक बनाती हैं। ये प्रतिक्रियाएँ आर्सेनिक के अधातु गुणधर्म की पुष्टि करती है।
आर्सेनिक अम्ल का सूत्र As(OH)3 है। क्षार द्वारा इस अम्ल के क्रियात्मक लवण आर्सेनाइट कहलाते हैं। आर्सेनिक आक्साइड आथवा संखिया का सूत्र As4O6 है। यह यौगिक कई अपर रूपों में मिलता है और शक्तिशाली संचयी (अक्युम्युलेटिव) विष है।
क्लोरीन, ब्रोमीन तथा आयोडीन के साथ आर्सेनिक त्रिसंयोजकीय यौगिक बनाता है। इन यौगिकों का विघटन बहुत कम हाता है। इस कारण इनमें लवण के गुण नहीं हैं।
आर्सेनिक के पाँच प्रधान यौगिक आक्साइड As2O5, आर्सेनिक अम्ल H3AsO4 तथा उससे बने आर्सिनेट सल्फाइड As2O5 और फ्लोराइड AsF5 हैं।
आर्सेनिक के कार्बनिक व्युत्पन्न भी बनाए गए हैं, जिनमें (CH)3 As, (CH3)4 As Cl, (CH3)2 As-As (CH3)2 और (CH3)2As OOH मुख्य हैं।
गुणात्मक विश्लेषण में आर्सेनिक को सल्फाइड के रूप में पारद, वंग (राँगा), एंटिमनी आदि के साथ अलग करते हैं। आर्सेनिक के यौगिक अधिकतर विषैले होते हैं। इसलिए इसकी सूक्ष्म मात्रा में उपस्थिति की पहचान करना, विलयन तथा गैस दोनों रूपों में, आवश्यक हो सकता है। आर्सेनाइट का विलयन ताँबे द्वारा अपचयित हो जाता है। ताँबें के टुकड़े को विलयन में डालने से उसपर आर्सेनिक की काली परत छा जाती है। AsH3 अथवा आर्सीन का वाष्प सिल्वर नाइट्रेट को उपचयित कर देता है। आर्सीन का वाष्प गर्म नली में आर्सेनिक की काली तह जमा देता है; इस परीक्षा को मार्श की परीक्षा कहा जाता है।
उपयोग
[संपादित करें]आर्सेनिक आक्साइड आर्सेनिक का सबसे उपयोगी यौगिक है। यह तांबे, सीसे तथा अन्य धातुओं के अयस्क से सहजात के रूप में निकाला जाता है। आर्सेनिक आक्साइड अन्य आर्सेनिक यौगिकों के निर्माण में काम आता है। इसका उपयोग काँच बनाने तथा चमड़े की वस्तुएँ सुरक्षित करने में होता है। इस काम में लेड आर्सेनाइट, कैल्सियम आर्सेनाइट और ताँबे के कार्बनिक आर्सेनाइट का विशेष उपयोग होता है। आर्सेनिक के कुछ अन्य यौगिक वर्णकों (रंगों) के लिए विशेष उपयोगी होते हैं।
आर्सेनिक का उपयोग मिश्र धातुओं के निर्माण में भी होता है। सीसे में एक प्रतिशत आर्सेनिक डालने से उसकी पुष्टता बढ़ जाती है। इस मिश्रण का उपयोग छर्रे बनाने में होता है। ताँबे के साथ थोड़ी मात्रा में आर्सेनिक मिलाने पर उसका आक्सीकरण तथा क्षरण रुक जाता है।
आर्सेनिक के यौगिक प्राय: विषैले होते हैं। वे शरीर की कोशिकाओं में पक्षाघात (पैरालिसिस) पैदा करते हैं तथा अंतड़ियों और ऊतकों को हानि पहुँचाते हैं। आर्सेनिक खाने पर सिरपीड़ा, चक्कर तथा वमन आदि लक्षण उत्पन्न होते हैं। कुछ व्यक्तियों का विचार है कि आर्सेनिक सूक्ष्म मात्रा में लाभकारी होता है। अत: उसके अनेक कार्बनिक तथा अकार्बनिक यौगिक रक्ताल्पता, तंत्रिकाव्याधि, गठिया, मलेरिया, प्रमेह तथा अन्य रोगों के उपचार में प्रयुक्त होते हैं। विशेषकर प्रमेह के उपचार में सालवारसन का उपयोग होता है, जो आर्सेनिक का कार्बनिक यौगिक आर्सफिनामीन हाइड्रोक्लोराइड है।
आर्सेनिक यौगिक उदरविष होते हैं। इस कारण वे पत्तियाँ खानेवाले कीटाणुओं को नष्ट करने में उपयोगी होते हैं। कैल्सियम आर्सिनेट टमाटर के कीड़े नष्ट करता है। लेड आर्सिनेट फल, फूल तथा अन्य हरी तरकारियों के कीड़ों को नष्ट करता है। उन फलों तथा तरकारियों को, जिनपर आर्सेनिक यौगिकों का छिड़काव हुआ हो, अच्छे प्रकार से धोकर खाना चाहिए।
उत्पादन
[संपादित करें]आर्सेनिक आक्साइड को कोक (तपाया हुआ पत्थर का कोयला) द्वारा अपचयित करके आर्सेनिक तत्त्व का बनाया जाता है। कुछ आर्सेनिक यौगिकों को गर्म करने पर उनका विघटन हो जाता है। इस प्रकार की आर्सेनिक तत्त्व रूप में बनाया जाता है। अच्छा तथा शुद्ध मणिभ आर्सेनिक पाने के लिए ताप का नियंत्रण आवश्यक है।
आर्सेनिक के यौगिक
[संपादित करें]आर्सेनिक ऑक्सीजन, हाइड्रोजन तथा क्लोरीन के साथ संयोग करके क्रमश: आक्साइड, हाइड्राइड तथा क्लोराइड बनाता है। इन यौगिकों की रचना तथा नाइट्रोजन एवं फास्फोरस के यौगिक की रचना में प्रचुर साम्य है। विशेषत: हाइड्राइड AsH3 उल्लेखनीय, जिसमें As की संयोजकता +3 है। अमोनिया तथा फास्फीन में भी ण् तथा फ्की संयोजकताएँ +3 हैं। फिर भी, आर्सेनिक के अमोनियम या फास्फोनियम जैसे लवण ज्ञात नहीं हैं।
आर्सेनिक अम्ल
[संपादित करें]दो अम्ल ज्ञात हैं-
- (1) आर्सीनियस अम्ल H3AsO3 जो आर्सीनियस आक्साइड को जल में विलयित करने पर बनता है-
- As2O3+3H2O- 2H3AsSO3
- (2) आर्सेनिक अम्ल H3AsSO4 : इसे आर्सीनियस आक्साइड को सान्द्र नाइट्रिक अम्ल में गर्म करने पर क्रिस्टल रूप में प्राप्त किया जाता है।
दोनों ही अम्ल त्रिक्षारकी (Tribasic) हैं। इसके तीनों हाइड्रोजन परमाणु आयनित हो सकते हैं और धातुओं द्वारा प्रतिस्थाप्य हैं। ये दोनों अम्ल क्षारों के साथ क्रिया करके क्रमश: आर्सेनाइट और आर्सेनेट लवण बनाते हैं। आर्सेनिक अम्ल फास्फोरिक अम्ल के समान हैं। सोडियम आर्सेनेट का प्रयोग घासपातनाशी के रूप में होता है। क्यूप्रिक हाइड्रोजन आर्सेनाइट (CuHAsO) में कीटाणुनाशी गुण पाये जाते हैं।
आर्सेनिक (III) आक्साइड (As2O3)
[संपादित करें]आर्सेनिक ट्राइआक्साइड, आर्सीनियस आक्साइड या श्वेत आर्सेनिक - यह श्वेत या रंगहीन यौगिक है जो As4O6 के रूप में पाया जाताहै। इसके तीन रूप ज्ञात हैं - अष्टफलकीय, एकनताक्षय तथा अक्रिस्टलीय रूप। ये तीनों रूप 218 पर वाष्पीकृत होते हैं और 500 पर उनके वाष्पघनत्व से As4O6 अणु का होना निश्चित होता है। यह जल में अल्पविलेय है किन्तु अम्लीय विलयन उत्पन्न करता है।
आक्सीकारकों द्वारा आर्सेनिक अम्ल में परिणत हो जाता है। उभयधर्मी होने के कारण अम्लों तथा क्षारों के साथ समान रूप से अभिक्रिया करता है। क्षारों के साथ आर्सेनाइट लवण बनते हैं। यदि अम्लीय विलयन में H2S गैस प्रवाहित की जाय तो आर्सेनिक (III) सल्फाइड का पीला अवक्षेप बनता है। गुणात्मक विश्लेषण में द्वितीय समूह में आर्सेनिक को इसी विधि से अवक्षेपित करते हैं। अपचायकों द्वारा आर्सीनियस आक्साइड आर्सेनिक धातुओं में बदल जाता है। नवजात हाइड्रोजन से अपचयन कराने पर आर्सीन बनता हैं।
यह अत्यन्त विषैला होने के कारण चूहों, मक्खियों तथा कीटों को नष्ट करने के लिए चारों के साथ मिश्रित किया जाता है। यह चमडे के परिरक्षण तथा वर्णकों के बनाने में भी प्रयुक्त होता है। औषधि की तरह भी प्रयुक्त।
आर्सेनिक आक्साइड As2O5
[संपादित करें]यह श्वेत प्रस्वेद्य क्रिस्टलविहीन ठोस है जो जल में विलयित होकर आर्सेनिक अम्ल बनाता है। अधिक गर्म करने पर आर्सेनियस अम्ल बनाता है। इसे आर्सेनिक तथा ऑक्सीजन के प्रत्यक्ष संयोग में नहीं बनाया जासकता। अत: आर्सीनियस आक्साइड को नाइट्रिक अम्ल में घोलकर और आर्सेनिक अम्ल को गर्म करके प्राप्त किया जाता है। वह अम्लीय होता है। इसके लवण आर्सेनेट कहलाते हैं।
आर्सेनिक हाइड्राइड AsH3 या आर्सीन
[संपादित करें]यह रंगहीन गैस है जो जल में तथा क्लोरोफार्म में बैंजीन में विलेय है। इसे किसी धातु आर्सेनाइड पर अम्ल की क्रिया से प्राप्त करते हैं। किसी आर्सेनिक यौगिक को नवजात हाइड्रोजन से अपचित कराकर भी इसे प्राप्त करते हैं। पंचम समूह के हाइड्रोजन की तरह उच्च ताप पर यह अपघटित हो जाती है और आर्सेनिक की पतली तह जमा होती है जिसे काला दर्पण कहते हैं। -
- 2 AsH3 --> 2As + 3H2
आर्सीन ज्वलनशीलन गैस है। यह प्रबल अपचायक है। यह पोटैसियम परमैंगनेट विलयन के रंग को उड़ा देती है। इसका उपयोग आधुनिक माइक्रोइलेक्ट्रानिक पुर्जे बनाने में किया जाता है।
चित्र
[संपादित करें]-
native arsenic
-
alchemic symbol
-
Arsenic complexes
-
grey Arsenic
-
yellow Arsenic
-
Polycyclic Arsenic