Glikolízis
| Ennek a szócikknek a megírásához egyetlen vagy kevés forrást használtak fel, ezért a szócikk tartalma egyoldalú is lehet. |
| Ez a szócikk feltüntet forrásokat, de azonosíthatatlan, hol használták fel őket a szövegben. Önmagában ez nem minősíti a szócikk tartalmát: az is lehet, hogy minden állítása pontos. Segíts lábjegyzetekkel ellátni az állításokat! Lásd még: A Wikipédia nem az első közlés helye |
A glikolízis egy anyagcsereút, melynek során egy molekula glükóz két molekula piruváttá oxidálódik. Az elnevezés a glükóz (glüküsz görögül: édes) és a lízis (lüszisz görögül: hasadás) szavakból származó összetétel. Ez a folyamat tehát a glükóz katabolizmusának kezdő lépése, mely három alapvető célt szolgál:
- ATP termelése (anaerob metabolizmus)
- Piruváttermelés a citrátciklus számára, illetve NADH termelése (aerob légzés)
- Hat, három szénatomos és piroszőlősav köztitermékek termelése más anyagcsere-folyamatok (például aminosav-szintézis) céljaira.
Mint az aerob és anaerob légzés alapfolyamata, a glikolízis az őstípusa az ismert egyetemes anyagcsere-folyamatoknak, és szinte az összes élő szervezet sejtjeiben megtalálható. A glikolízis sok prokarióta valamint mitokondrium nélküli (például vörösvérsejt) vagy oxigénhiányos környezetnek kitett (például nehéz munkát végző izom) eukarióta sejt legfőbb energiaforrása (anaerob légzés).
A glikolízis mind eukariótákban, mind prokariótákban a citoszolban zajlik, bár a növényekben egyes reakciók – melyek a Calvin–Benson-ciklusban is megtalálhatók – a kloroplasztiszokban történnek. Ez a konzervativizmus alátámasztja a feltételezést, hogy a glikolízis igen ősi folyamat, az első prokariótákban jelent meg 3,5 milliárd éve vagy még annál is régebben.
A glikolízis legáltalánosabb és legismertebb útja az Embden–Meyerhof-útvonal, melyet először Gustav Embden és Otto Fritz Meyerhof fedezett fel. Bár a glikolízis kifejezést egyéb, alternatív útvonalakra is vonatkozhat (például a Entner-Doudoroff útvonal), ebben a cikkben az Embden-Meyerhof útvonalat taglaljuk.
A glikolízis két szakaszra bontható:[1]
- Befektetési szakasz: ATP-fogyasztó
- Termelő szakasz: a fogyasztottnál több ATP keletkezik
A glikolízis felfedezése
[szerkesztés]A glikolitikus folyamatok módszeres tanulmányozását Louis Pasteur kezdte meg 1860-ban, amikor felfedezte, hogy az erjedésért mikroorganizmusok a felelősek. 1897-ben Eduard Buchner kimutatta, hogy bizonyos sejtkivonatokkal erjedést lehet előidézni. A következő lépés az volt, amikor Arthur Harden és William Young 1905-ben megállapította, hogy a fermentáció létrejöttéhez egy hőérzékeny, nagy molekulatömegű szubcelluláris frakció (az enzimek) és egy kevésbé hőérzékeny, alacsony molekulatömegű sejtplazmafrakció (ADP, ATP, NAD+ és egyéb kofaktorok) együttes jelenléte szükséges. Az egyes konkrét részreakciókat 1940-re határozták meg, leginkább Otto Fritz Meyerhof és később Luis Leloir munkássága eredményeként. A glikolízis részleteinek feltárását leginkább az nehezítette meg, hogy az átmeneti termékeknek nagyon rövid volt az élettartama, és nagyon alacsony volt a nyugalmi koncentrációja.
Áttekintés
[szerkesztés]A glikolízis nettó egyenlete:
| D-glükóz | piruvát | ||||
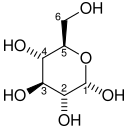
|
+ 2 NAD+ + 2 ADP + 2 Pi | 
|
2 | 
|
+ 2 NADH + 2 ATP + 2 H+ + 2 H2O |
A látszólag hiányzó egyensúlyt a Pi csoportok állítják helyre:[2]
- Mindegyik hidrogénfoszfátként (HPO2−4) van jelen, melyek disszociációja összesen 2 protont ad.
- Mindegyikük lead egy oxigénatomot, ezzel két oxigénatomot adva. A töltésegyensúlyt az ADP és az ATP közti töltéskülönbség tartja fenn: míg az ADP 3 negatív töltéssel rendelkezik, az ATP 4-gyel.
Egyszerű anaerob fermentáció során egy molekula glükóz két molekula piruváttá alakul, s ennek során két molekula ATP szintetizálódik. A legtöbb sejt további reakciók során „visszafizeti” az elhasznált NAD+-ot etanol vagy laktát termelése mellett. Egyes baktériumok szervetlen vegyületeket használnak hidrogén akceptorként a NAD+ regenerálásához.
Aerob légzést végző sejtek sokkal több ATP-t szintetizálnak, de már nem a glikolízis részeként, hanem további aerob reakciókban, melyek a glikolízis során megtermelt piruvátot és NADH + H+-t használják. Az eukarióta aerob respiráció során a glikolízisben közvetlenül és közvetve (NADH-kból) termelődő ATP-ken kívül további 25 (tehát összesen 30-32) molekula ATP termelődik minden egyes lebontott glükózmolekula után, de ezek többsége a glikolízis szubsztrátszintű foszforilációjától teljesen eltérő módon szintetizálódik.
Mivel az egy lebontott glükózmolekulára eső energiatermelés sokkal alacsonyabb az anaerob légzés, mint az aerob légzés esetében, hipoxiás körülmények között sokkal intenzívebb a glikolízis, egészen addig, amíg valamilyen más, anaerob módon oxidálható szubsztrát (például zsírsavak) rendelkezésre nem áll.
Glikolízis
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A glikolízis reakciói
[szerkesztés]A glikolízis első szakasza
[szerkesztés]Az első öt lépést előkészítő (vagy befektetési) szakasznak is szokták nevezni, mivel a sejt energiát használ fel ahhoz, hogy a hatszénatomos glükózt két háromszénatomos trióz-foszfáttá (glicerinaldehid-3-foszfát) alakítsa át.
| A glikolízis első reakciója a glükóz foszforilációja glükóz-6-foszfáttá (G6P) a hexokináz enzimcsaládba tartozó enzimek közreműködésével. Ez a reakció ATP-t fogyaszt, és elsősorban az a szerepe, hogy alacsonyan tartsa a glükózkoncentrációt, ami elősegíti a glükóz folyamatos beáramlását a sejtbe a plazmamembrán-transzportereken keresztül. Ugyanakkor meggátolja a glükóz-kiáramlást, mivel a plazmamembránban nincsenek glükóz-6-foszfát-transzporterek. A glükóz az intracelluláris keményítő vagy glikogén lebontásából eredhet.
Az állati szervezetekben a hexokináz egyik izoenzime, a glükokináz (vagyis hexokináz IV) is szerephez jut a májban. Ennek az enzimnek sokkal kisebb a glükóz iránti affinitása (Km-je a normoglikémia környékén van) és regulációjában is különbözik. Ezek az eltérések a máj normoglikémiát fenntartó szerepére világítanak rá. Kofaktor: Mg2+ |
| ||||||||||||||||||||
| Ezután a G6P izomerizációja történik fruktóz-6-foszfáttá (F6P) a foszfohexóz izomeráz enzim segítségével. A fruktóz – foszforilációt követően – ezen a ponton léphet be a glükolitikus reakciósorba.
A szerkezetváltozás redoxireakcióval jön létre: az aldehidcsoport alkohollá redukálódik, míg a szomszédos szénatom hidroxilcsoportja ketonná oxidálódik. Ez a reakció normál körülmények között nem preferált, de a (glikolízis következő reakciója által) folyamatosan alacsonyan tartott fruktóz-6-foszfát-szint mégis fenntartja. Magas fruktóz-6-foszfát-koncentráció esetén ez a reakció azonnal a visszájára fordul. |
| ||||||||||||||||||||
| Egy újabb ATP felhasználását ebben a lépésben két dolog is indokolja: A glikolitikus folyamat innentől fogva irreverzibilis és az újabb foszfátcsoport bevitele jelentette többletenergia destabilizálja a cukormolekulát. Mivel a foszfofruktokináz I enzim által katalizált reakció nagyon kedvező, a lépés gyakorlatilag irreverzibilis, ezért a glükoneogenezis során egy eltérő reakcióutat kell használni az ellenkező irányú lépés végrehajtásához. Ez egyúttal a reguláció kulcspontjává is teszi ezt a lépést (lásd lejjebb). [Koplalás során a fruktóz-2,6-biszfoszfát (a PFK-1 allosztérikus aktivátora) koncentrációja alacsony, ezért a PFK-1 aktivitása is csökkent, ennek következtében fokozódik a glukoneogenezis].
Kofaktor: Mg2+ |
| ||||||||||||||||||||
| Az előző lépésben előidézett destabilizáció lehetővé teszi, hogy az aldoláz (aldoláz A) a hatszénatomos fruktóz-1,6-biszfoszfátot két háromszénatomos trióz-foszfátra, egy dihidroxiaceton-foszfátra és egy glicerinaldehid-3-foszfátra bontsa. |
| ||||||||||||||||||||||||||
| A triózfoszfát-izomeráz hatékonyan alakítja át egymásba a dihidroxiaceton-foszfátot és a glicerinaldehid-3-foszfátot. Ez lehetővé teszi, hogy a dihidroxiaceton-foszfát is ugyanazon a reakcióúton haladjon végig, mint a glicerinaldehid-3-foszfát, leegyszerűsítve ezáltal a regulációt. |
| ||||||||||||||||||||
- Megjegyzés – Az utolsó lépést a pirofoszfát-dependens foszfofruktokináz (PFP vagy PPi-PFK) is katalizálhatja. Ez az enzim ugyanazt a reakciót katalizálja, mint a PFK1 (más néven ATP-PFK), de ATP helyett pirofoszfátot (PPi) használ foszfátdonorként. Ez a reakció reverzibilis, megnövelve ezáltal a glikolitikus metabolizmus rugalmasságát. Ez az enzim állati (és emberi) szervezetekben nem, csak növényi, baktérium- és archaeasejtekben fordul elő.
A glikolízis második szakasza
[szerkesztés]A második, kifizetődő (pay-off) szakasz szintén öt lépésből áll, ezalatt a keletkezett glicerinaldehid-3-foszfát piruváttá alakul át. Egy glicerinaldehid-3-foszfát átalakulása alatt kettő ATP keletkezik.
(Összegezve 1 db glükóz-foszfátból 2db ATP molekula felhasználásával 2 db piruvát molekula keletkezik, amelyek egyenként 2, összesen tehát 4 db ATP molekulát adnak, amikor glicerinaldehid-foszfátból létrejönnek. Mivel a glükóznak a fruktóz-biszfoszfáttá alakítása 2 db ATP molekulát vett igénybe, kívülről nézve a glikolízis összesen 4-2=2 ATP molekulát termelt.)
- Az első lépésben a glicerinaldehid-3-foszfát 1,3-biszfoszfogliceráttá alakul át egy anorganikus foszfát beépülésével és az aldehidcsoport oxidálásával. Ezt a reverzibilis folyamatot a glicerinaldehid-3-foszfát-dehidrogenáz katalizálja.
- A következő lépésben szubsztrátszintű foszforiláció történik: a magas csoportátviteli potenciálú foszfátcsoportot a foszfoglicerát-kináz enzim átviszi az ADP-re, így az 1,3-biszfoszfoglicerátból 3-foszfoglicerát keletkezett. Standard körülmények között a reakció exergonikus, ám a koncentrációviszonyoktól függően a folyamat visszafele is lejátszódhat.
- Ezután a 3-foszfoglicerát 2-foszfogliceráttá alakul, a reakciót a foszfoglicerát-mutáz katalizálja.
- Enoláz enzim segítségével a 2-foszfoglicerátból foszfoenolpiruvát (PEP) lesz, a reakció során vízkilépés történik.
- A foszfoenolpiruváz az 1,3-biszfoszfgliceráthoz hasonlóan magas csoportátviteli potenciállal rendelkezik, így a glikolízis utolsó lépésében is szubsztrátszintű foszforiláció történik. A reakcióban a piruvát-kináz játszik szerepet, és a glikolízis harmadik, egyben utolsó irreverzibilis reakcióját alkotja.
A 3. lépést katalizálhatja a pirofoszfát-dependens foszfofruktokináz (PFP vagy PPi-PFK). Ez ugyanazt a reakciót katalizálja, mint a PFK1 (más néven ATP-PFK), de foszfátdonorja pirofoszfát (PPi), nem ATP. E reakció reverzibilis, növelve a glikolízis rugalmasságát. Ez az enzim nem található meg állatokban, de a legtöbb növényben, egyes eukarióta egysejtűekben, baktériumokban és archeákban igen.[3] Egy ritkább ADP-dependens PFK (ADP-PFK) megtalálható egyes archeákban.[4]
A glikolízis regulációja
[szerkesztés]A glikolízis szabályozása a három irreverzibilis reakciót katalizáló enzim szabályozásán keresztül történik.
- Az első szabályozható pont a glükóz -> glükóz-6-foszfát átalakulás. A reakciót katalizáló hexokináz allosztérikus gátlója a reakció végterméke, vagyis a glükóz-6-foszfát.
- A második szabályozási lehetőség a foszfofruktokináz I regulációja. Az enzimet allosztérikusan aktiválja a megnövekedett AMP szint, amely a sejt alacsony energiatöltöttségét jelenti, illetve a fruktóz-2,6-biszfoszfát. Allosztérikusan gátol a magas ATP-, citrát- és H+-szint. A folyamat hormonálisan is szabályozható: az inzulin aktiválja, míg a glukagon gátolja az enzim működését. Mindkét enzim a fruktóz-2,6-biszfoszfát mennyiségének a megváltoztatásával fejti ki a hatását.
- Az utolsó regulációs pont a glikolízis utolsó reakciója, amelyet a piruvát-kináz katalizál. Allosztérikusan aktivál a fruktóz-1,6-biszfoszfát (feed-forward mechanizmus), hogy ne halmozódjanak fel a köztitermékek. Allosztérikusan gátol az ATP, alanin és az acetil-koenzim-A.
Jegyzetek
[szerkesztés]- ↑ Mehta S: Glycolysis – Animation and Notes. PharmaXchange, 2011. szeptember 20.
- ↑ Lane AN, Fan TW, Higashi RM (2009). „Metabolic acidosis and the importance of balanced equations”. Metabolomics 5 (2), 163–165. o. DOI:10.1007/s11306-008-0142-2.
- ↑ Reeves RE, South DJ, Blytt HJ, Warren LG (1974). „Pyrophosphate: D-fructose 6-phosphate 1-phosphotransferase. A new enzyme with the glycolytic function 6-phosphate 1-phosphotransferase.”. J Biol Chem 249, 7737–7741. o. PMID 4372217.
- ↑ Selig, M., Xavier K. B., Santos H. and Schönheit P. (1997). „Comparative analysis of Embden-Meyerhof and Entner-Doudoroff glycolytic pathways in hyperthermophilic archaea and the bacterium Thermotoga.”. Arch Microbiol 167, 217-232. o. PMID 9075622.
Források
[szerkesztés]- Ádám Veronika (szerk.): Orvosi biokémia (Semmelweis Kiadó, 2016) ISBN 9789633314005








