Deret Balmer

Deret Balmer atau garis Balmer dalam fisika atom, adalah sebutan dari salah satu dari enam deret bernama yang menggambarkan garis spektrum emisi atom hidrogen. Deret Balmer dihitung dengan menggunakan rumus Balmer, persamaan empiris ditemukan oleh Johann Balmer pada tahun 1885.
Spektrum kasatmata cahaya dari hidrogen menunjukkan empat panjang gelombang, 410 nm, 434 nm, 486 nm, dan 656 nm, yang sesuai dengan emisi foton oleh elektron dalam keadaan tereksitasi dalam proses transisi ke tingkat kuantum dijelaskan dengan bilangan kuantum utama n sama dengan 2.[1] Terdapat juga sejumlah garis Balmer ultraviolet dengan panjang gelombang yang lebih pendek dari 400 nm.
Tinjauan
[sunting | sunting sumber]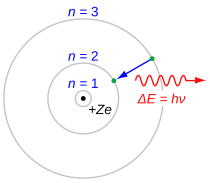
Deret Balmer ditandai oleh transisi elektron dari n ≥ 3 ke n = 2, di mana n mengacu pada bilangan kuantum radial atau bilangan kuantum utama elektron. Transisi ini diberi nama secara berurutan oleh huruf Yunani: n = 3 ke n = 2 dinamakan H-
| Transisi | 3→2 | 4→2 | 5→2 | 6→2 | 7→2 | 8→2 | 9→2 | →2 |
|---|---|---|---|---|---|---|---|---|
| Nama | H- |
H- |
H- |
H- |
H- |
H- |
H- |
|
| Panjang gelombang (nm)[2] | 656,3 | 486,1 | 434,1 | 410,2 | 397,0 | 388,9 | 383,5 | 364,6 |
| Warna | Merah | Akua | Violet | Violet | (Ultraviolet) | (Ultraviolet) | (Ultraviolet) | (Ultraviolet) |
Meskipun fisikawan menyadari adanya emisi atom sebelum tahun 1885, mereka tidak memiliki alat untuk memprediksi secara akurat di mana garis spektrum akan muncul. Persamaan Balmer memprediksi empat garis penyerapan/emisi kasatmata dari hidrogen dengan akurasi yang tinggi. Persamaan Balmer terinspirasi persamaan Rydberg sebagai generalisasi hal tersebut, dan persamaan ini pada gilirannya menyebabkan fisikawan menemukan deret Lyman, Paschen, dan Brackett yang memprediksi garis penyerapan/emisi lainnya dari hidrogen yang ditemukan di luar spektrum kasatmata.
H-alfa merah familiar dengan garis spektrum gas hidrogen, yang merupakan transisi dari kulit n = 3 ke kulit deret Balmer n = 2, adalah salah satu warna mencolok dari alam semesta. Hal ini memberikan kontribusi garis merah terang untuk spektrum emisi atau ionisasi nebula, seperti Nebula Orion, yang sering kali daerah H II ditemukan di wilayah pembentukan bintang. Dalam gambar warna nyata, nebula ini memiliki warna merah muda jelas dari kombinasi garis Balmer kasatmata yang bahwa hidrogen memancarkan emisi.
Kemudian, ditemukan bahwa ketika garis spektrum dari spektrum hidrogen diteliti pada resolusi yang sangat tinggi, mereka ditemukan menjadi garis kembar berjarak dekat. Pembagian ini disebut struktur halus. Penelitian tersebut juga menemukan bahwa elektron yang tereksitasi bisa melompat ke deret Balmer n = 2 dari orbital di mana n lebih besar dari 6, memancarkan nuansa ungu.

Rumus Balmer
[sunting | sunting sumber]Balmer memperhatikan bahwa satu bilangan memiliki hubungan dengan setiap garis dalam spektrum hidrogen yang berada di wilayah cahaya tampak. Bilangan tersebut adalah 364,50682 nm. Ketika setiap bilangan bulat lebih tinggi dari 2 dikuadratkan dan kemudian dibagi dengan kuadrat itu sendiri dikurangi 4, kemudian bilangan dikalikan 364,50682 (lihat persamaan di bawah) memberikan panjang gelombang garis lain dalam spektrum hidrogen. Dengan rumus ini, ia mampu menunjukkan bahwa beberapa pengukuran garis yang dibuat pada masanya dengan spektroskopi sedikit tidak akurat dan rumus memprediksikan garis yang kemudian ditemukan meskipun belum diamati. Bilangannya juga terbukti sebagai batas dari deret ini.
Persamaan Balmer dapat digunakan untuk mencari panjang gelombang penyerapan/garis emisi dan awalnya dipresentasikan sebagai berikut (kecuali perubahan notasi untuk memberikan konstanta Balmer sebagai B):
Di mana
- adalah panjang gelombang.
- B adalah sebuah konstanta dengan nilai 3,6450682×10−7 m atau 364,50682 nm.
- m sama dengan 2.
- n adalah bilangan bulat dengan n > m.
Pada tahun 1888 fisikawan Johannes Rydberg menggeneralisasikan persamaan Balmer untuk semua transisi hidrogen. Persamaan umum digunakan untuk menghitung deret Balmer adalah contoh spesifik dari rumus Rydberg dan mengikuti sebagai penataan ulang matematika timbal balik sederhana dari rumus di atas (secara konvensional menggunakan notasi m untuk n sebagai konstanta integral tunggal yang diperlukan):
di mana
Peran dalam astronomi
[sunting | sunting sumber]Deret Balmer ini sangat berguna dalam astronomi karena garis Balmer muncul di berbagai objek bintang karena banyaknya hidrogen di alam semesta, dan oleh karena itu sering terlihat dan relatif kuat dibandingkan dengan garis dari unsur-unsur lain.
Spektral klasifikasi bintang, terutama penentuan suhu permukaan, didasarkan pada kekuatan relatif dari garis spektrum, dan deret Balmer khususnya sangat penting. Karakteristik lain dari sebuah bintang yang dapat ditentukan dengan analisis dekat spektrum meliputi gravitasi permukaan (berhubungan dengan ukuran fisik) dan komposisi.
Karena garis Balmer yang biasa terlihat di spektrum berbagai objek, mereka sering digunakan untuk menentukan kecepatan radial berkat pergeseran doppler dari garis Balmer. Hal ini memiliki kegunaan penting di seluruh astronomi, dari mendeteksi bintang biner, eksoplanet, objek kompak seperti bintang neutron dan lubang hitam (dengan gerak hidrogen pada piringan akresi di sekitarnya), mengidentifikasi kelompok objek dengan gerakan yang sama dan mungkin asal mulanya (kelompok gerak, gugus bintang, gugus galaksi, dan puing-puing dari tabrakan), menentukan jarak (pergeseran merah sebenarnya) galaksi atau kuasar, dan mengidentifikasi objek asing oleh analisis spektrumnya.
Garis Balmer dapat muncul sebagai garis penyerapan atau emisi dalam spektrum, tergantung pada sifat dari objek yang diamati. Pada bintang, garis Balmer biasanya terlihat dalam penyerapan, dan garis tersebut "kuat" pada bintang dengan suhu permukaan sekitar 10.000 kelvin (spektral tipe A). Spektrum pada galaksi yang paling spiral dan tidak teratur, AGN, daerah H II, dan nebula planeter, garis Balmer merupakan garis emisi.
Pada spektrum bintang, garis H-epsilon (transisi 7-2) sering bercampur dengan garis penyerapan lain disebabkan oleh kalsium terionisasi yang dikenal oleh para astronom sebagai "H" (sebutan asli yang diberikan oleh Fraunhofer). Artinya, panjang gelombang H-epsilon ini cukup dekat dengan CaH pada 396,847 nm, dan tidak dapat diselesaikan pada spektrum resolusi rendah. Garis H-zeta (transisi 8-2) juga sama bercampur dengan garis helium netral terlihat pada bintang yang panas.
Lihat pula
[sunting | sunting sumber]- Deret spektrum hidrogen
- Spektroskopi astronomi
- Klasifikasi bintang
- Model Bohr
- Pembuktian teori dan eksperimen persamaan Schrödinger
- Rumus Rydberg
Referensi
[sunting | sunting sumber]- ^ C.R. Nave (2006). HyperPhysics: Hydrogen Spectrum. Georgia State University. Accessed March 1st, 2008.
- ^ Eisberg and Resnick (1985). Quantum Physics. John Wiley and Sons. hlm. 97.
- ^ "CODATA Recommended Values of the Fundamental Physical Constants: 2006" (PDF). Committee on Data for Science and Technology (CODATA). NIST.










