Adrenalone
L'adrenalone è un agonista adrenergico usato come vasocostrittore locale ed emostatico. In passato trovò impiego anche come composto utilizzato per prolungare l'azione di anestetici locali. È il chetone corrispondente dell'adrenalina (epinefrina).[2]. Contrariamente all'epinefrina, l'adrenalone agisce principalmente sui recettori alfa-1 adrenergici, ma si caratterizza per una scarsa affinità per i recettori beta. Il farmaco è ormai da considerarsi obsoleto, essendo stato superato dall'introduzione in commercio di altre sostanze emostatiche, come ad esempio la trombina, il fibrinogeno e gli analoghi della vasopressina.
| Adrenalone | |
|---|---|
 | |
| Caratteristiche generali | |
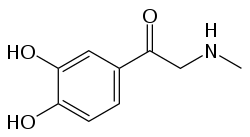
| Formula bruta o molecolare | C9H11NO3 |
| Massa molecolare (u) | 181.189 g/mol |
| Numero CAS | |
| Numero EINECS | 202-756-9 |
| Codice ATC | A01 |
| PubChem | 7436 |
| DrugBank | DBDB13394 |
| SMILES | O=C(c1cc(O)c (O)cc1)CNC |
| Dati farmacocinetici | |
| Metabolismo | MAO, COMT |
| Escrezione | renale |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
Caratteristiche strutturali e chimiche
modificaL'adrenalone cloridrato ha aspetto di una polvere cristallina bianca, dal sapore amaro e leggermente acido, scarsamente solubile nell'etere etilico, solubile in acqua e nell'etanolo. Il punto di fusione dell'adrenalone cloridrato è pari a 243 °C.
Farmacodinamica
modificaIl farmaco agisce come un agonista selettivo sui recettori alfa-1 adrenergici. Inibisce la dopamina
Farmacocinetica
modificaDopo l'applicazione locale, nel sangue possono essere riscontrate solo tracce del composto. Ciò è in parte una conseguenza della vasocostrizione provocata dal farmaco stesso per l'interazione con i recettori alfa-1 adrenergici. Come l'epinefrina, l'adrenalone viene metabolizzato dalle catecol-O-metil transferasi (COMT), dando origine al composto 3O-metiladrenalone, che a sua volta è N-demetilizzato da parte della monoamino-ossidasi (MAO). Il farmaco talvolta subisce prima una metabolizzazione da parte della MAO e successivamente è sottoposto a metabolizzazione dalle COMT. In entrambi i casi il composto che ne deriva, il 3O-metil-N-demetiladrenalone è successivamente coniugato a solfato o glucuronide e escreto attraverso il rene.
Usi clinici
modificaIl farmaco veniva utilizzato come vasocostrittore ed antiemorragico topico, con gli stessi effetti dell'adrenalina[2]. Trovava indicazione, in associazione con l'adrenalina e sotto forma di collirio, anche per il trattamento del glaucoma. Molti derivati dell'adrenalone trovano similmente impiego come agenti oftalmici.[5][6]
Effetti collaterali e indesiderati
modificaIn alcuni soggetti la vasocostrizione indotta dall'adrenalone causava lesioni locali e talvolta necrosi.
Controindicazioni
modificaIl farmaco è controindicato in caso di ipersensibilità nota al principio attivo oppure agli eccipienti contenuti nella formulazione farmaceutica. È inoltre controindicato in pazienti con sanguinamento che origina da vasi di grandi dimensioni.
Interazioni
modificaIl trattamento di associazione con altri antitrombotici non è indicato, perché questi ultimi spesso contrastano con l'azione dell'adrenalone.
Note
modifica- ^ Sigma Aldrich; rev. del 25.10.2012, riferita al cloridrato
- ^ a b (DE) V. Dinnendahl, U. Fricke, Arzneistoff-Profile, vol. 4, 23ª ed., Eschborn, Govi Pharmazeutischer Verlag, 2010, ISBN 978-3-7741-9846-3.
- ^ Goldstein M, Contrera JF, Inhibition of dopamine beta oxidase by adrenalone, in Nature, vol. 192, 1961, pp. 1081, PMID 13899905.
- ^ Goldstein M, Musacchio JM, Kenin MC, Contrera JF, Rice MD, The inhibition in vivo of norepinephrine synthesis by adrenalone, in Biochem. Pharmacol., vol. 11, 1962, pp. 809–11, PMID 13899911.
- ^ Gary C. Visor, Novel Adrenalone Derivatives and Their Use as Ophthalmic Agents, University of Florida, 1982.
- ^ Bodor N, Kaminski JJ, Roller RG, Improved delivery through biological membranes VI. Potent sympathomimetic adrenalone derivatives, in International Journal of Pharmaceutics, 1978.