Ibridizzazione
L'ibridazione (o ibridizzazione[1]) è un procedimento di combinazione matematica di un certo numero di orbitali atomici (orbitali s, p) di valenza di un atomo, aventi energie poco diverse, che permette di ottenere per quell'atomo altrettanti nuovi orbitali ibridi equivalenti (isoenergetici tra loro, finché possibile), coi lobi orientati lungo le direzioni dettate dalla combinazione matematica stessa. Questi nuovi orbitali ibridi potranno essere usati dall'atomo per formare legami con altri atomi. Verrà preferito l'uso di orbitali ibridi, rispetto a quello di orbitali atomici, se i legami con essi formati con altri atomi comporterà un guadagno di stabilità per la molecola (legami più forti).
Il numero di orbitali ibridi ottenuti è uguale al numero di quelli che vengono combinati, cosicché il numero totale di orbitali di valenza dell'atomo non cambia. I lobi degli orbitali ibridi hanno nuove direzioni rispetto a quelli atomici e tali direzioni formano tra loro angoli caratteristici per ogni combinazione (sp, sp2, sp3).
Il processo di ibridazione può essere accompagnato da un processo di promozione di uno o più elettroni in orbitali a livello energetico più alto allo scopo di ottenere un maggior numero di elettroni spaiati; questo ha un costo energetico che però può spesso (non sempre) essere più che compensato dal guadagno connesso con la formazione di un numero maggiore di legami e, come accennato sopra, legami più forti.
L'ibridazione consente di stabilire la forma geometrica di una molecola o di uno ione con il metodo di Gillespie (1957), che è un affinamento della teoria già elaborata nel 1940 da Nevil Sidgwick e Herbert Marcus Powell.
Le ibridazioni degli orbitali s e p possono essere di tipo:
- sp (dà luogo a due orbitali ibridi e strutture lineari);[2] esempi di ibridazione sp si hanno nelle molecole di azoto (N2), monossido di carbonio (CO), acetilene (C2H2), e fluoruro di berillio (BeF2);
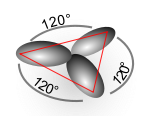
- sp2 (dà luogo a tre orbitali ibridi e strutture trigonali planari);[3] esempi di ibridazione sp2 si hanno nelle molecole di trifluoruro di boro (BF3), triossido di zolfo (SO3), diossido di zolfo (SO2), etene (C2H4), benzene (C6H6) e grafene;
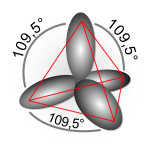
- sp3 (dà luogo a quattro orbitali ibridi e strutture tetraedriche).[4] esempi di ibridazione sp3 si hanno nelle molecole di metano (CH4), ammoniaca (NH3), acqua (H2O), acido perclorico (HClO4), acido solforico (H2SO4) e acido fosforico (H3PO4).
Per molecole ipervalenti come o il concetto di ibridazione non può essere esteso, ma si fa riferimento a modelli più complessi; infatti, non possiamo descrivere in termini di ibridazione il rimescolamento di orbitali d con orbitali s e p poiché la differenza di energia è troppo elevata.[5]
Come determinare il tipo di ibridazione degli orbitali di un atomo
modificaÈ possibile determinare il tipo di ibridazione dell'atomo centrale di una molecola.
Partendo dalla formula di struttura, si contano i legami
- con ibridazione sp: forma 2 legami
σ diretti a 180° uno dall'altro (lineare) - con ibridazione sp2: forma 3 legami
σ diretti a 120° uno dall'altro, verso i vertici di un triangolo equilatero (oppure: 2 legamiσ + 1 lone pair) (triangolare planare) - con ibridazione sp3: forma 4 legami
σ diretti a 109,5°[7] uno dall'altro, verso i vertici di un tetraedro (oppure: 3 legamiσ + 1 lone pair; oppure: 2 legamiσ + 2 lone pair; ...) - con ibridazione dsp2: forma 4 legami
σ diretti a 90° uno dall'altro, verso i vertici di un quadrato (per ioni metallici in configurazione elettronica d8: Ni2+, Pd2+, Pt2+... etc.[8])
Quindi, se la somma di legami
- 2, lo stato di ibridazione è sp
- 3, lo stato di ibridazione è sp2
- 4, lo stato di ibridazione è sp3
A partire dalla formula grezza, si possono seguire le seguenti fasi:
- Scrivere la configurazione elettronica esterna dell'atomo centrale;
- Contare il numero di legami
σ che questo atomo forma con gli altri atomi della molecola; - Promuovere tanti elettroni quanti servono per formare il numero di legami determinati al punto 2;
- Individuare quali e quanti orbitali sono ibridati, contando anche i doppietti di non legame (“lone pair”), ma senza contare i legami
π .
Primo esempio
modificaIndividuare il tipo di ibridazione dell'atomo di C (atomo centrale) nella molecola CH4 .
- Scrivere la configurazione elettronica esterna dell'atomo centrale;
C 2s2 2p2
- Contare il numero di legami che quest'atomo forma con gli altri atomi della molecola (cioè vedere con quanti atomi è legato);
Il carbonio nella molecola CH4 forma 4 legami
- Promuovere tanti elettroni quanti servono per formare il numero di legami così determinati (scrivere la formula di struttura);
È necessario promuovere 1 elettrone sugli orbitali p, per poter disporre di 4 elettroni spaiati
- Individuare quali e quanti orbitali sono ibridati, contando anche i doppietti di non legame ("lone pair"), ma senza contare i legami
π .
Si ibridano 4 orbitali (1 orbitale s e 3 orbitali p),
C s p3
ottenendo così 4 orbitali isoenergetici diretti a 109,5°: l'ibridazione è sp3. Ciascun elettrone spaiato lega un atomo di H.
Secondo esempio
modificaIndividuare il tipo di ibridazione dell'atomo di C (atomo centrale) nello ione HCO3−
- Scrivere la configurazione elettronica esterna dell'atomo centrale;
C 2s2 2p2
- Contare il numero di legami che questo atomo forma con gli altri atomi della molecola (cioè vedere con quanti atomi è legato);
Il carbonio nello ione HCO3− forma 3 legami
- Promuovere tanti elettroni quanti servono per formare il numero di legami così determinati (scrivere la formula di struttura);
È necessario promuovere 1 elettrone sull'orbitale p, per poter disporre di 4 elettroni spaiati (di questi: 3 vengono impiegati per formare legami
- Individuare quali e quanti orbitali sono ibridati, contando anche i doppietti di non legame (“lone pair”), ma senza contare i legami
π .
Si ibridano 3 orbitali (1 orbitale s e 2 orbitali p), resta 1 orbitale p non ibridato per formare il legame
C s p2
ottenendo così 3 orbitali degeneri diretti a 120°: l'ibridazione è sp2.
Note
modifica- ^ Il termine "ibridizzazione" è un calco dall'inglese "hybridization".
- ^ Silvestroni, p. 58.
- ^ Silvestroni, pp. 58-59.
- ^ Silvestroni, p. 59.
- ^ Fondamenti di Chimica, p. 359.
- ^ Da Silvestroni P., Fondamenti di chimica, ed. Zanichelli
- ^ 109,5° è il valore approssimato, quello esatto per l'angolo tetraedrico è esprimibile come arccos(-1/3).
- ^ ... Co+, Rh+, Ir+, Cu3+, Ag3+, Au3+ ed altri
Bibliografia
modifica- Paolo Silvestroni, Fondamenti di chimica, 10ª ed., CEA, 1996, pp. 56-65, ISBN 88-408-0998-8.
- T. W. Graham Solomons, Chimica organica, 2ª ed., Bologna, Zanichelli, 2001, pp. 30-37, ISBN 88-08-09414-6.
- Mario Rippa, La Chimica di Rippa, Ferrara, Bovolenta - Zanichelli, 2006, pp.
- Brown - LeMay - Bursten - Murphy - Woodward - Stoltzfus, Fondamenti di Chimica, 2018, ISBN 8879598538.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su ibridizzazione
Collegamenti esterni
modifica- (EN) hybridization / hybrid orbital, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4160838-0 |
|---|

