Urea: differenze tra le versioni
m aggiornamento sintassi del template {{references}} |
Nessun oggetto della modifica |
||
| (44 versioni intermedie di 33 utenti non mostrate) | |||
| Riga 1: | Riga 1: | ||
<!--Chemiobox base per composti cristallini molecolari--> |
<!--Chemiobox base per composti cristallini molecolari--><!--Sostituire le xxx con i valori richiesti, se non li si conosce inserire --> |
||
<!--Sostituire le xxx con i valori richiesti, se non li si conosce inserire --> |
|||
{{Composto chimico |
{{Composto chimico |
||
|immagine1_nome = Harnstoff.svg |
|immagine1_nome = Harnstoff.svg |
||
|immagine1_dimensioni = |
|immagine1_dimensioni = |
||
|immagine1_descrizione = Formula di struttura |
|immagine1_descrizione = Formula di struttura |
||
| |
|immagine2_nome = Urea 3D ball.png |
||
|immagine2_dimensioni = |
|||
|immagine3_dimensioni = 120px |
|||
| |
|immagine5_nome = Urea 3D spacefill.png |
||
|immagine5_dimensioni = |
|||
|immagine4_dimensioni=120px |
|||
|nome_IUPAC = diaminometanone |
|nome_IUPAC = diaminometanone |
||
|nomi_alternativi = |
|nomi_alternativi = carbammide<br />carbonildiammide |
||
carbammide<br />carbonildiammide |
|||
|titolo_caratteristiche_generali = --- |
|titolo_caratteristiche_generali = --- |
||
| ⚫ | |||
|formula = CH<sub>4</sub>N<sub>2</sub>O |
|||
| ⚫ | |||
|aspetto = solido incolore |
|aspetto = solido incolore |
||
|numero_CAS = 57-13-6 |
|||
|titolo_proprietà_chimico-fisiche = --- |
|titolo_proprietà_chimico-fisiche = --- |
||
|densità_condensato = 1,33 |
|densità_condensato = 1,33 |
||
|solubilità_acqua = 1193 |
|solubilità_acqua = {{M|1193|u=g/L}} a {{M|25|u=°C}} |
||
|temperatura_di_fusione = 133 |
|temperatura_di_fusione = {{M|133|u=°C}} ({{M|406|u=K}}) |
||
|entalpia_di_fusione = 14,790 |
|entalpia_di_fusione = 14,790 |
||
|entropia_di_fusione = 36,4 |
|entropia_di_fusione = 36,4 |
||
| Riga 29: | Riga 25: | ||
|entalpia_combustione = -635 |
|entalpia_combustione = -635 |
||
|titolo_indicazioni_sicurezza = --- |
|titolo_indicazioni_sicurezza = --- |
||
|simbolo1= |
|simbolo1 = |
||
|simbolo2= |
|simbolo2 = |
||
|simbolo3= |
|simbolo3 = |
||
|simbolo4= |
|simbolo4 = |
||
|simbolo5= |
|simbolo5 = |
||
|frasiR=- |
|frasiR = - |
||
|frasiS=- |
|frasiS = - |
||
|frasiH= --- |
|frasiH = --- |
||
|consigliP= ---<ref>scheda dell'urea su [http://gestis-en.itrust.de IFA-GESTIS]</ref> |
|consigliP = ---<ref>scheda dell'urea su [http://gestis-en.itrust.de IFA-GESTIS] {{Webarchive|url=https://web.archive.org/web/20191016183546/http://gestis-en.itrust.de/ |date=16 ottobre 2019 }}</ref> |
||
}} |
}} |
||
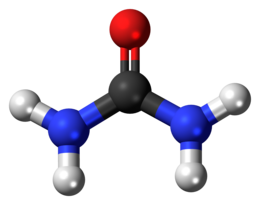
L''''urea'''(urèa<ref>Dizionario Zingarelli, ed. 1998</ref> o ùrea<ref>http://www.dizionario.rai.it/poplemma.aspx?lid=4303&r=12786 |
L''''urea''' (urèa<ref>Dizionario Zingarelli, ed. 1998</ref> o ùrea<ref>{{Cita web |url=http://www.dizionario.rai.it/poplemma.aspx?lid=4303&r=12786 |titolo=Dizionario d'ortografia e di pronunzia |accesso=18 novembre 2015 |dataarchivio=19 novembre 2015 |urlarchivio=https://web.archive.org/web/20151119111233/http://www.dizionario.rai.it/poplemma.aspx?lid=4303&r=12786 |urlmorto=sì }}</ref>) è la [[ammide|diammide]] dell'[[acido carbonico]]; in [[condizioni normali]] si presenta come un [[solido cristallino]] incolore. |
||
In tutti i [[tetrapodi]], con l'eccezione degli [[uccelli]] e di alcuni [[rettili]], è la sostanza |
In tutti i [[tetrapodi]], con l'eccezione degli [[uccelli]] e di alcuni [[rettili]], è la sostanza tramite la quale vengono eliminati dall'[[organismo]] i prodotti [[azoto|azotati]] del [[metabolismo]]. Negli [[ruminanti|erbivori poligastrici]] è possibile riscontrarne tracce nella [[saliva]]. |
||
== |
== Storia == |
||
[[File:Urea_Synthesis_Woehler.png|sinistra|miniatura|380x380px|Catione ammonio e anione cianato]] |
|||
| ⚫ | Fu |
||
Fu scoperta da [[Hilaire Rouelle]] nel [[1773]] nell'[[urina]] umana. |
|||
| ⚫ | Fu il primo [[composto organico]] a essere sintetizzato artificialmente (nel [[1828]] da [[Friedrich Wöhler]]<ref>{{Cita pubblicazione|cognome1=Shorter |nome1=J. |anno=1978 |titolo=The conversion of ammonium cyanate into urea—a saga in reaction mechanisms |rivista=[[Chemical Society Reviews]] |volume=7 |numero=1 |pp=1-14 |editore=[[Royal Society of Chemistry]] |doi=10.1039/CS9780700001 |url=http://pubs.rsc.org/en/Content/ArticleLanding/1978/CS/cs9780700001#!divAbstract |accesso=26 novembre 2014 |richiestasottoscrizione=yes}}</ref>), impiegando esclusivamente reagenti inorganici; fu originariamente preparata facendo reagire [[cianato di argento]] con [[cloruro di ammonio]], con l'intenzione di ottenere [[cianato di ammonio]]. Avendo notato che il prodotto non presentava le proprietà tipiche dei cianati, Wöhler ripeté la sintesi impiegando [[cianato di piombo]] e una [[soluzione acquosa]] di [[ammoniaca]], con lo scopo di ottenere cristalli di maggior purezza: si accorse allora che il prodotto aveva le caratteristiche di un composto organico, e inizialmente ritenne che si trattasse di un [[alcaloide]]. Eseguì allora i saggi per il riconoscimento degli alcaloidi ma ottenne esiti negativi e si rese conto che i suoi cristalli si comportavano come l'urea, il cui comportamento era stato studiato e descritto da [[Joseph Proust]] e [[William Prout]]. Il confronto con l'urea ricavata dall'urina lo convinse di aver sintetizzato quel composto. |
||
::[[File:Urea Synthesis Woehler.png|none|380px]]{{clear|left}} |
|||
([[ammonio|catione ammonio]] e [[cianato|anione cianato]]) |
|||
Fu un duro colpo per i [[vitalismo|vitalisti]], i quali affermavano che la chimica degli organismi viventi fosse fondamentalmente differente da quella della materia inanimata. |
|||
Avendo notato che il prodotto non presentava le proprietà tipiche dei cianati, Wöhler ripeté la sintesi impiegando [[cianato di piombo]] e una soluzione acquosa di [[ammoniaca]], con lo scopo di ottenere cristalli di maggior purezza. Si accorse allora che il prodotto aveva le caratteristiche di un composto organico, e inizialmente ritenne che si trattasse di un [[alcaloide]]. Eseguì allora i saggi per il riconoscimento degli alcaloidi. Ottenne esiti negativi, ma si rese conto che i suoi cristalli si comportavano come l'urea, il cui comportamento era stato studiato e descritto da [[Joseph Louis Proust]] e [[William Prout]]. Il confronto con l'urea ricavata dall'urina lo convinse di aver sintetizzato quel composto. Fu un duro colpo per i [[vitalismo|vitalisti]], i quali affermavano che la chimica degli organismi viventi fosse fondamentalmente differente da quella della materia inanimata. |
|||
==Caratteristiche chimiche e fisiche== |
==Caratteristiche chimiche e fisiche== |
||
| Riga 59: | Riga 55: | ||
===Reattività=== |
===Reattività=== |
||
L'urea può reagire con gli [[alcooli]] per produrre i [[carbammati]] etilici, o uretani, e con gli [[esteri]] dell'[[acido malonico]] per produrre gli [[acido barbiturico|acidi barbiturici]]. |
L'urea può reagire con gli [[alcooli]] per produrre i [[carbammati]] etilici, o uretani, e con gli [[esteri]] dell'[[acido malonico]] per produrre gli [[acido barbiturico|acidi barbiturici]]. |
||
[[File:Barbituric acid synthesis.svg|center|Reazione di sintesi di barbiturico a partire da urea e acido malonico|frame]] |
[[File:Barbituric acid synthesis.svg|center|Reazione di sintesi di [[barbiturico]] a partire da urea e [[acido malonico]].|frame]] |
||
== |
==Filogenesi== |
||
| ⚫ | |||
===Sintesi=== |
|||
Gli animali acquatici, come i [[pesci]], non necessitano di questa molecola, in quanto possono rilasciare direttamente l'ammoniaca nel mezzo acquatico che li circonda. Questa infatti [[Diffusione molecolare|diffonde]] rapidamente nella grande massa d'acqua, riducendo in brevissimo tempo la propria concentrazione al di sotto dei livelli tossici. Tali organismi sono detti [[ammoniotelici]]. |
|||
Nei vertebrati terrestri invece si rende necessario un sistema che permetta di trasportare e accumulare l'ammoniaca in modo sicuro all'interno dell'organismo. Tale sistema si concreta nel ciclo dell'urea e questi animali si dicono [[ureotelici]]. |
|||
| ⚫ | Si differenziano in questo campo gli [[aves|uccelli]], che non avendo la possibilità di diluire le sostanze tossiche in scorte d'acqua, principalmente a causa del peso che dovrebbero trasportare, hanno sviluppato un sistema basato sull'[[acido urico]], che può essere escreto con un utilizzo molto scarso di acqua: tali organismi si dicono [[uricotelici]]. Tra i vertebrati questo sistema è utilizzato anche da alcuni [[reptilia|rettili]].<ref>{{Cita libro|nome=Kenneth V.|cognome=Kardong|titolo=Vertebrati - Anatomia comparata, funzione, evoluzione|anno=2005|editore=McGraw-Hill PG Italia|città=Milano|isbn=88-386-6168-5}}</ref> |
||
==Fisiologia umana== |
|||
===Il ciclo dell'urea=== |
|||
{{Vedi anche|Ciclo dell'urea}} |
{{Vedi anche|Ciclo dell'urea}} |
||
[[File:Urea cycle.svg|thumb| |
[[File:Urea cycle.svg|thumb|left|Ciclo dell'urea]] |
||
L'urea viene sintetizzata nel [[ciclo dell'urea]] a partire dall'[[ammoniaca]] o per ossidazione degli [[amminoacidi]]. Nel ciclo dell'urea i [[Gruppo amminico|gruppi amminici]] provenienti dall'ammoniaca |
L'urea viene sintetizzata nel [[ciclo dell'urea]] a partire dall'[[ammoniaca]] o per ossidazione degli [[amminoacidi]]. Nel ciclo dell'urea i [[Gruppo amminico|gruppi amminici]] provenienti dall'ammoniaca e dall'[[aspartato]] sono convertiti in urea con una serie di [[Intermedio di reazione|intermedi di reazione]] (ornitina → citrullina → argininsuccinato → arginina → ornitina). La produzione di urea avviene principalmente nel [[fegato]] e in misura minore nei [[reni]]<ref name=biochem>{{cita libro|David L.|Nelson|Principi di Biochimica di Lehninger|febbraio 2002|[[Nicola Zanichelli Editore|Zanichelli]]|Bologna|coautori=Michael M. Cox|isbn=88-08-09035-3}}</ref>. |
||
===Secrezione=== |
===Secrezione=== |
||
L'urea viene rilasciata nel [[sangue]], nel quale la si trova disciolta con [[Concentrazione|concentrazioni]] comprese tra |
L'urea viene rilasciata nel [[sangue]], nel quale la si trova disciolta con [[Concentrazione (chimica)|concentrazioni]] comprese tra 25 e 90 [[mole|mmol]]/[[litro|L]] (nell'[[Homo sapiens|uomo]]). |
||
| ⚫ | Attraverso la [[circolazione sanguigna]], l'urea raggiunge i [[reni]], dove viene [[escrezione|escreta]] come componente dell'[[urina]]. Una piccola quantità di urea è presente nel [[sudore]] - talvolta nella fase terminale dell'[[insufficienza renale cronica]] è possibile riscontrare la presenza di [[brina uremica]], ovvero cristalli di urea, sulla cute dei pazienti. |
||
Ogni giorno vengono espulsi, tramite minzione, tra i 10 ed i 25 g di urea. |
|||
===Funzione=== |
===Funzione=== |
||
Gli amminoacidi che non vengono utilizzati per la [[sintesi proteica]] vengono [[ossidazione|ossidati]] e perdono il gruppo amminico per azione delle [[transaminasi]] |
Gli amminoacidi che non vengono utilizzati per la [[sintesi proteica]] vengono [[ossidazione|ossidati]] e perdono il gruppo amminico per azione delle [[transaminasi]]; altre reazioni [[catabolismo|cataboliche]] portano alla sintesi di prodotti azotati e ammoniaca. |
||
L'accumulo di questi prodotti e il conseguente aumento della concentrazione di [[azoto]] nel [[citoplasma]] può portare il [[pH]] [[cellula]]re a valori tossici; di conseguenza l'azoto di scarto viene convertito in urea, che costituisce un composto "sicuro" per trasportare l'azoto senza rischi. |
|||
===Metabolismo=== |
|||
| ⚫ | Attraverso la [[circolazione sanguigna]] l'urea raggiunge i [[reni]], dove viene [[escrezione|escreta]] come componente dell'[[urina]]. Una piccola quantità di urea è presente nel [[sudore]] - talvolta nella fase terminale dell'[[insufficienza renale cronica]] è possibile riscontrare la presenza di [[brina uremica]], ovvero cristalli di urea, sulla cute dei pazienti |
||
==Sintesi artificiale== |
==Sintesi artificiale== |
||
L'urea viene sintetizzata industrialmente sfruttando il |
L'urea viene sintetizzata industrialmente sfruttando il [[processo di Bosch-Meiser]], che si fonda sulla sintesi del [[carbammato d'ammonio]] a partire da [[anidride carbonica|biossido di carbonio]] e [[ammoniaca]], e sulla successiva reazione di decomposizione del carbammato ottenendo urea e [[acqua]]: |
||
#<tt> 2 NH<sub>3</sub> + CO<sub>2</sub> → H<sub>2</sub>N-COONH<sub>4</sub></tt> |
|||
:<chem> 2 NH3 + CO2 -> H2N-COONH4 -> (NH2)2CO + H2O</chem> |
|||
#<tt> H<sub>2</sub>N-COONH<sub>4</sub> → (NH<sub>2</sub>)<sub>2</sub>CO + H<sub>2</sub>O</tt> |
|||
Nel suo complesso la formazione di urea dagli elementi è un [[processo esotermico]] con |
Nel suo complesso la formazione di urea dagli elementi è un [[processo esotermico]] con |
||
I grandi impianti di produzione dell'urea (fino a |
I grandi impianti di produzione dell'urea (fino a 4000 t/giorno) utilizzano prevalentemente tre processi commerciali sviluppati dall'olandese [[Stamicarbon]], l'italiana [[Snamprogetti]] e la giapponese [[Toyo Engineering Corporation]]. La Stamicarbon è stata la prima azienda, nel 1966, a decomporre il carbammato tramite il flusso di CO<sub>2</sub>; la Snamprogetti ha introdotto qualche anno dopo l'uso della NH<sub>3</sub><ref>{{cita testo|lingua=en|autore=Vaclav Smil|titolo=Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production|url=http://books.google.it/books?id=G9FljcEASycC&pg=PA136&dq=snamprogetti&hl=it&sa=X&ei=NpQkU-DsEYW8ygOSsoDgCg&ved=0CEgQ6AEwAg#v=onepage&q=snamprogetti&f=false|editore=MIT Press|data=2004|p=136}}</ref>. |
||
==Utilizzi== |
==Utilizzi== |
||
===Diagnostica=== |
===Diagnostica=== |
||
| ⚫ | L'urea è presente nel [[sangue]] e nell'[[urina]]. È il prodotto finale del [[catabolismo]] delle [[Proteina|proteine]]. Viene eliminata dai [[Rene|reni]], attraverso l'[[urina]]. La [[intervallo di confidenza|presenza fisiologica]] di urea nel [[sangue]] della specie umana va da circa 18 a 40 mg/dl e viene misurata attraverso la reazione del biureto, ma essi variano in funzione dell'età del soggetto. La determinazione dell'urea nel siero umano o degli animali è nota impropriamente come [[azotemia]]. In realtà la molecola che viene determinata è l'urea dalla quale viene poi ricavato attraverso un calcolo stechiometrico il valore del cosiddetto B.U.N. (''Blood Urea Nitrogen'', o azoto ureico). L'azoto ureico contribuisce per 28/60 al peso della molecola, ed è quindi uguale a circa la metà della concentrazione plasmatica dell'urea. Il termine '''uremia''' dovrebbe essere inteso come il valore misurato di urea nel sangue, ma è diventato nome comune dell'[[uremia|insufficienza renale terminale]], sebbene l'''iperuremia'' ne sia solo un sintomo. |
||
L'urea è presente nel [[sangue]] e nell'[[urina]]. È il prodotto finale del [[catabolismo]] delle [[Proteina|proteine]]. Viene eliminata dai [[Rene|reni]], attraverso l'[[urina]]. |
|||
| ⚫ | Il valore chiamato [[Azoto ureico|B.U.N.]] è utilizzato soprattutto nei paesi anglosassoni per indicare il livello di azotemia, e si calcola dividendo il valore di urea espresso in mg/dl per 2,14. I valori fisiologici nella specie umana e nel cane sono circa {{M|9|–|20|u=mg/dl}}. L'urea viene utilizzata inoltre nell'[[Test del respiro|Urea breath test]] per dimostrare la presenza di ''[[Helicobacter pylori]]''. |
||
| ⚫ | La [[intervallo di confidenza|presenza fisiologica]] di urea nel [[sangue]] della specie umana |
||
Il termine '''uremia''' dovrebbe essere inteso come il valore misurato di urea nel sangue, ma è diventato nome comune dell'[[uremia|insufficienza renale terminale]], sebbene l'''iperuremia'' ne sia solo un sintomo. |
|||
| ⚫ | |||
L'urea viene utilizzata inoltre nell'[[Test del respiro|Urea breath test]] per dimostrare la presenza di ''[[Helicobacter pylori]]''. |
|||
===Cosmesi=== |
===Cosmesi=== |
||
Diverse [[Crema (farmacologia)|creme]], o altri tipi di prodotti a base di urea sono disponibili per il trattamento [[cosmesi|cosmetico]] di disturbi [[dermatologia|dermatologici]] quali [[psoriasi]], [[xerosi]], [[onicomicosi]], [[ittiosi]], [[eczema|eczemi]], [[cheratosi]] e [[callo]]sità. L'urea è utilizzata per le sue proprietà [[idratazione della pelle|idratanti]] dovute alla capacità di trattenere l'acqua |
Diverse [[Crema (farmacologia)|creme]], o altri tipi di prodotti a base di urea, sono disponibili per il trattamento [[cosmesi|cosmetico]] di disturbi [[dermatologia|dermatologici]] quali [[psoriasi]], [[xerosi]], [[onicomicosi]], [[ittiosi]], [[eczema|eczemi]], [[cheratosi]] e [[callo]]sità. L'urea è utilizzata per le sue proprietà [[idratazione della pelle|idratanti]] dovute alla capacità di trattenere l'acqua e per l'effetto di rimozione delle cellule morte generato sulla [[cute]]. Viene, inoltre, usata anche in certi collutori. |
||
Viene, inoltre, usata anche in certi collutori. |
|||
===Agricoltura e zootecnica=== |
===Agricoltura e zootecnica=== |
||
| Riga 107: | Riga 108: | ||
===Industria=== |
===Industria=== |
||
{{Vedi anche|AdBlue}} |
|||
L'urea viene utilizzata come componente principale di un additivo utilizzato per abbattere le emissioni inquinanti di ossidi di azoto presenti nelle emissioni dovute a combustioni di impianti industriali (abbattimento [[NOx|NO<sub>x</sub>]] in impianti di incenerimento urbano, posizionato nei post-combustori), e si sta affermando anche nei veicoli |
L'urea viene utilizzata come componente principale di un additivo utilizzato per abbattere le emissioni inquinanti di ossidi di azoto presenti nelle emissioni dovute a combustioni di impianti industriali (abbattimento [[NOx|NO<sub>x</sub>]] in impianti di incenerimento urbano, posizionato nei post-combustori), e si sta affermando anche nei veicoli a [[motore Diesel]] (nome commerciale [[AdBlue]]): viene iniettata nel [[collettore di scarico]] una soluzione acquosa al 32,5% di urea pura che, tramite riduzione chimica favorita da opportuni catalizzatori, trasforma gli ossidi di [[azoto]] in azoto molecolare e acqua ([[Riduzione selettiva catalitica|SCR]], ''Selective Catalytic Reduction''). La composizione e gli standard di qualità sono regolati dalla norma DIN70070. |
||
Altri usi industriali riguardano la produzione di materie [[plastica|plastiche]] e [[colla|adesivi]], insieme alla [[melammina]] e alla [[formaldeide]]. |
Altri usi industriali riguardano la produzione di materie [[plastica|plastiche]] e [[colla|adesivi]] (come ad esempio la [[colla ureica]]), insieme alla [[melammina]] e alla [[formaldeide]]. |
||
==Tossicologia== |
==Tossicologia== |
||
{{disclaimer|medico}} |
{{disclaimer|medico}} |
||
L'urea può essere [[irritante]] per gli [[occhi]] e ad alte concentrazioni può causare [[dermatite|dermatiti]]. L'ingestione di urea non è di norma tossica alle concentrazioni in cui è presente nell'urina umana. Concentrazioni più alte o assunzioni troppo ravvicinate possono far salire l'azotemia a livelli pericolosi. |
L'urea può essere [[irritante]] per gli [[occhi]] e ad alte concentrazioni può causare [[dermatite|dermatiti]]. L'ingestione di urea non è di norma tossica alle concentrazioni in cui è presente nell'urina umana. Concentrazioni più alte o assunzioni troppo ravvicinate possono far salire l'azotemia a livelli pericolosi. |
||
==Filogenesi== |
|||
| ⚫ | |||
| ⚫ | |||
== Note == |
== Note == |
||
<references/> |
|||
== Voci correlate == |
== Voci correlate == |
||
* [[ |
* [[AdBlue]] |
||
* [[Ureine]] |
|||
* [[N-idrossiurea]] |
* [[N-idrossiurea]] |
||
* [[Ciclo dell'urea]] |
* [[Ciclo dell'urea]] |
||
| Riga 135: | Riga 131: | ||
* [[Brina uremica]] |
* [[Brina uremica]] |
||
* [[Azoto ureico]] |
* [[Azoto ureico]] |
||
* [[Idrolisi dell'urea]] |
|||
== Altri progetti == |
== Altri progetti == |
||
{{interprogetto |
{{interprogetto|wikt=urea}} |
||
== Collegamenti esterni == |
== Collegamenti esterni == |
||
* {{ |
* {{Collegamenti esterni}} |
||
{{clear}} |
|||
<br style="clear:both;"/> |
|||
{{Controllo di autorità}} |
{{Controllo di autorità}} |
||
{{Portale|agricoltura|chimica}} |
{{Portale|agricoltura|chimica}} |
||
Versione attuale delle 21:12, 13 giu 2024
| Urea | |
|---|---|
 | |
 | |
 | |
| Nome IUPAC | |
| diaminometanone | |
| Nomi alternativi | |
| carbammide carbonildiammide | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CH4N2O |
| Massa molecolare (u) | 60,06 g/mol |
| Aspetto | solido incolore |
| Numero CAS | |
| Numero EINECS | 200-315-5 |
| PubChem | 1176 |
| DrugBank | DBDB03904 |
| SMILES | C(=O)(N)N |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,33 |
| Solubilità in acqua | 1193 g/L a 25 °C |
| Temperatura di fusione | 133 °C (406 K) |
| 14,790 | |
| 36,4 | |
| Proprietà termochimiche | |
| −333,11 | |
| S0m(J·K−1mol−1) | 104,26 |
| C0p,m(J·K−1mol−1) | 92,79 |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
L'urea (urèa[2] o ùrea[3]) è la diammide dell'acido carbonico; in condizioni normali si presenta come un solido cristallino incolore.
In tutti i tetrapodi, con l'eccezione degli uccelli e di alcuni rettili, è la sostanza tramite la quale vengono eliminati dall'organismo i prodotti azotati del metabolismo. Negli erbivori poligastrici è possibile riscontrarne tracce nella saliva.
Storia
[modifica | modifica wikitesto]
Fu scoperta da Hilaire Rouelle nel 1773 nell'urina umana.
Fu il primo composto organico a essere sintetizzato artificialmente (nel 1828 da Friedrich Wöhler[4]), impiegando esclusivamente reagenti inorganici; fu originariamente preparata facendo reagire cianato di argento con cloruro di ammonio, con l'intenzione di ottenere cianato di ammonio. Avendo notato che il prodotto non presentava le proprietà tipiche dei cianati, Wöhler ripeté la sintesi impiegando cianato di piombo e una soluzione acquosa di ammoniaca, con lo scopo di ottenere cristalli di maggior purezza: si accorse allora che il prodotto aveva le caratteristiche di un composto organico, e inizialmente ritenne che si trattasse di un alcaloide. Eseguì allora i saggi per il riconoscimento degli alcaloidi ma ottenne esiti negativi e si rese conto che i suoi cristalli si comportavano come l'urea, il cui comportamento era stato studiato e descritto da Joseph Proust e William Prout. Il confronto con l'urea ricavata dall'urina lo convinse di aver sintetizzato quel composto.
Fu un duro colpo per i vitalisti, i quali affermavano che la chimica degli organismi viventi fosse fondamentalmente differente da quella della materia inanimata.
Caratteristiche chimiche e fisiche
[modifica | modifica wikitesto]La molecola dell'urea è planare nella struttura cristallina, mentre assume una forma piramidale nella fase gassosa[5]. Allo stato solido ogni ossigeno è legato ad altre due molecole con un legame a idrogeno.
Data la sua capacità di formare legami a idrogeno, l'urea è altamente solubile in acqua. Inoltre l'urea può formare clatrati intrappolando numerosi composti organici.
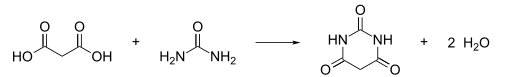
Reattività
[modifica | modifica wikitesto]L'urea può reagire con gli alcooli per produrre i carbammati etilici, o uretani, e con gli esteri dell'acido malonico per produrre gli acidi barbiturici.
Filogenesi
[modifica | modifica wikitesto]L'urea si trova con le medesime funzioni nella maggior parte dei vertebrati terrestri (tetrapodi).
Gli animali acquatici, come i pesci, non necessitano di questa molecola, in quanto possono rilasciare direttamente l'ammoniaca nel mezzo acquatico che li circonda. Questa infatti diffonde rapidamente nella grande massa d'acqua, riducendo in brevissimo tempo la propria concentrazione al di sotto dei livelli tossici. Tali organismi sono detti ammoniotelici.
Nei vertebrati terrestri invece si rende necessario un sistema che permetta di trasportare e accumulare l'ammoniaca in modo sicuro all'interno dell'organismo. Tale sistema si concreta nel ciclo dell'urea e questi animali si dicono ureotelici.
Si differenziano in questo campo gli uccelli, che non avendo la possibilità di diluire le sostanze tossiche in scorte d'acqua, principalmente a causa del peso che dovrebbero trasportare, hanno sviluppato un sistema basato sull'acido urico, che può essere escreto con un utilizzo molto scarso di acqua: tali organismi si dicono uricotelici. Tra i vertebrati questo sistema è utilizzato anche da alcuni rettili.[6]
Fisiologia umana
[modifica | modifica wikitesto]Il ciclo dell'urea
[modifica | modifica wikitesto]
L'urea viene sintetizzata nel ciclo dell'urea a partire dall'ammoniaca o per ossidazione degli amminoacidi. Nel ciclo dell'urea i gruppi amminici provenienti dall'ammoniaca e dall'aspartato sono convertiti in urea con una serie di intermedi di reazione (ornitina → citrullina → argininsuccinato → arginina → ornitina). La produzione di urea avviene principalmente nel fegato e in misura minore nei reni[7].
Secrezione
[modifica | modifica wikitesto]L'urea viene rilasciata nel sangue, nel quale la si trova disciolta con concentrazioni comprese tra 25 e 90 mmol/L (nell'uomo).
Attraverso la circolazione sanguigna, l'urea raggiunge i reni, dove viene escreta come componente dell'urina. Una piccola quantità di urea è presente nel sudore - talvolta nella fase terminale dell'insufficienza renale cronica è possibile riscontrare la presenza di brina uremica, ovvero cristalli di urea, sulla cute dei pazienti.
Ogni giorno vengono espulsi, tramite minzione, tra i 10 ed i 25 g di urea.
Funzione
[modifica | modifica wikitesto]Gli amminoacidi che non vengono utilizzati per la sintesi proteica vengono ossidati e perdono il gruppo amminico per azione delle transaminasi; altre reazioni cataboliche portano alla sintesi di prodotti azotati e ammoniaca.
L'accumulo di questi prodotti e il conseguente aumento della concentrazione di azoto nel citoplasma può portare il pH cellulare a valori tossici; di conseguenza l'azoto di scarto viene convertito in urea, che costituisce un composto "sicuro" per trasportare l'azoto senza rischi.
Sintesi artificiale
[modifica | modifica wikitesto]L'urea viene sintetizzata industrialmente sfruttando il processo di Bosch-Meiser, che si fonda sulla sintesi del carbammato d'ammonio a partire da biossido di carbonio e ammoniaca, e sulla successiva reazione di decomposizione del carbammato ottenendo urea e acqua:
Nel suo complesso la formazione di urea dagli elementi è un processo esotermico con
I grandi impianti di produzione dell'urea (fino a 4000 t/giorno) utilizzano prevalentemente tre processi commerciali sviluppati dall'olandese Stamicarbon, l'italiana Snamprogetti e la giapponese Toyo Engineering Corporation. La Stamicarbon è stata la prima azienda, nel 1966, a decomporre il carbammato tramite il flusso di CO2; la Snamprogetti ha introdotto qualche anno dopo l'uso della NH3[8].
Utilizzi
[modifica | modifica wikitesto]Diagnostica
[modifica | modifica wikitesto]L'urea è presente nel sangue e nell'urina. È il prodotto finale del catabolismo delle proteine. Viene eliminata dai reni, attraverso l'urina. La presenza fisiologica di urea nel sangue della specie umana va da circa 18 a 40 mg/dl e viene misurata attraverso la reazione del biureto, ma essi variano in funzione dell'età del soggetto. La determinazione dell'urea nel siero umano o degli animali è nota impropriamente come azotemia. In realtà la molecola che viene determinata è l'urea dalla quale viene poi ricavato attraverso un calcolo stechiometrico il valore del cosiddetto B.U.N. (Blood Urea Nitrogen, o azoto ureico). L'azoto ureico contribuisce per 28/60 al peso della molecola, ed è quindi uguale a circa la metà della concentrazione plasmatica dell'urea. Il termine uremia dovrebbe essere inteso come il valore misurato di urea nel sangue, ma è diventato nome comune dell'insufficienza renale terminale, sebbene l'iperuremia ne sia solo un sintomo.
Il valore chiamato B.U.N. è utilizzato soprattutto nei paesi anglosassoni per indicare il livello di azotemia, e si calcola dividendo il valore di urea espresso in mg/dl per 2,14. I valori fisiologici nella specie umana e nel cane sono circa 9-20 mg/dl. L'urea viene utilizzata inoltre nell'Urea breath test per dimostrare la presenza di Helicobacter pylori.
Cosmesi
[modifica | modifica wikitesto]Diverse creme, o altri tipi di prodotti a base di urea, sono disponibili per il trattamento cosmetico di disturbi dermatologici quali psoriasi, xerosi, onicomicosi, ittiosi, eczemi, cheratosi e callosità. L'urea è utilizzata per le sue proprietà idratanti dovute alla capacità di trattenere l'acqua e per l'effetto di rimozione delle cellule morte generato sulla cute. Viene, inoltre, usata anche in certi collutori.
Agricoltura e zootecnica
[modifica | modifica wikitesto]L'urea è un fertilizzante azotato, molto utilizzato per il suo alto titolo in azoto (l'80% dell'urea prodotta è destinata a questo scopo), e viene usata nelle resine ureiche (20%). Molti batteri presenti nel terreno infatti possiedono un enzima chiamato ureasi in grado di idrolizzare l'urea in ammoniaca e anidride carbonica secondo la reazione (NH2)2CO + H2O → CO2 + 2 NH3, rendendo in questo modo l'azoto disponibile per le piante.
Esiste anche l'urea ad uso zootecnico, che può essere introdotta nelle razioni per ruminanti, la cui microflora batterica ruminale ne ricava pregiate proteine batteriche; indicativamente l'integrazione proteica nelle razioni per vitelloni, 300 - 400 grammi di proteine, potrebbe essere ottenuta con poco più di un centinaio di grammi di urea a costi inferiori. Nella pratica viene talora usata in funzione del costo delle farine proteiche (in primis la farina di estrazione di soia), ma solo in sostituzione parziale e con una introduzione graduale per permettere l'assuefazione della flora batterica.
Industria
[modifica | modifica wikitesto]L'urea viene utilizzata come componente principale di un additivo utilizzato per abbattere le emissioni inquinanti di ossidi di azoto presenti nelle emissioni dovute a combustioni di impianti industriali (abbattimento NOx in impianti di incenerimento urbano, posizionato nei post-combustori), e si sta affermando anche nei veicoli a motore Diesel (nome commerciale AdBlue): viene iniettata nel collettore di scarico una soluzione acquosa al 32,5% di urea pura che, tramite riduzione chimica favorita da opportuni catalizzatori, trasforma gli ossidi di azoto in azoto molecolare e acqua (SCR, Selective Catalytic Reduction). La composizione e gli standard di qualità sono regolati dalla norma DIN70070.
Altri usi industriali riguardano la produzione di materie plastiche e adesivi (come ad esempio la colla ureica), insieme alla melammina e alla formaldeide.
Tossicologia
[modifica | modifica wikitesto]L'urea può essere irritante per gli occhi e ad alte concentrazioni può causare dermatiti. L'ingestione di urea non è di norma tossica alle concentrazioni in cui è presente nell'urina umana. Concentrazioni più alte o assunzioni troppo ravvicinate possono far salire l'azotemia a livelli pericolosi.
Note
[modifica | modifica wikitesto]- ^ scheda dell'urea su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ Dizionario Zingarelli, ed. 1998
- ^ Dizionario d'ortografia e di pronunzia, su dizionario.rai.it. URL consultato il 18 novembre 2015 (archiviato dall'url originale il 19 novembre 2015).
- ^ J. Shorter, The conversion of ammonium cyanate into urea—a saga in reaction mechanisms, in Chemical Society Reviews, vol. 7, n. 1, Royal Society of Chemistry, 1978, pp. 1-14, DOI:10.1039/CS9780700001. URL consultato il 26 novembre 2014.
- ^ Peter Godfrey, Brown, Ronald and Hunter, Andrew, The shape of urea, in Journal of Molecular Structure, vol. 413-414, 1997, pp. 405–414, DOI:10.1016/S0022-2860(97)00176-2.
- ^ Kenneth V. Kardong, Vertebrati - Anatomia comparata, funzione, evoluzione, Milano, McGraw-Hill PG Italia, 2005, ISBN 88-386-6168-5.
- ^ David L. Nelson, Michael M. Cox, Principi di Biochimica di Lehninger, Bologna, Zanichelli, febbraio 2002, ISBN 88-08-09035-3.
- ^ (EN) Vaclav Smil, Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production, MIT Press, 2004, p. 136.
Voci correlate
[modifica | modifica wikitesto]- AdBlue
- N-idrossiurea
- Ciclo dell'urea
- Ureasi
- Poliurea
- Tiourea
- Test del respiro
- Urea (minerale)
- Brina uremica
- Azoto ureico
- Idrolisi dell'urea
Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «urea»
Wikizionario contiene il lemma di dizionario «urea» Wikimedia Commons contiene immagini o altri file su urea
Wikimedia Commons contiene immagini o altri file su urea
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) urea, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 24812 · LCCN (EN) sh85141359 · GND (DE) 4159153-7 · BNF (FR) cb122447595 (data) · J9U (EN, HE) 987007529769005171 · NDL (EN, JA) 00568752 |
|---|
