Fibrillazione atriale
| Fibrillazione atriale | |
|---|---|
 | |
| Specialità | cardiologia |
| Classificazione e risorse esterne (EN) | |
| MeSH | D001281 |
| MedlinePlus | 000184 |
| eMedicine | 151066 |
La fibrillazione atriale è un'alterazione del ritmo cardiaco (aritmia) ad origine dagli atri del cuore. È una complessa patologia elettrica degli atri, eterogenea dal punto di vista fisiopatologico e clinico, spesso multifattoriale, che presenta costantemente due caratteristiche: l'attivazione elettrica rapida e apparentemente caotica del tessuto atriale e l'aumentato rischio tromboembolico[1][2].
La fibrillazione atriale è il risultato di un gran numero di disordini cardiaci ed extracardiaci: da malattie strutturali, come le valvulopatie e le cardiomiopatie, all'ipertensione arteriosa, a malattie genetiche ereditarie, ai distiroidismi, fino ai casi in cui non è possibile determinare la causa, detti idiopatici.
L'approccio clinico corrente, oltre ad affrontare la patologia cardiaca o extracardiaca sottostante, mira a trattare i sintomi e a minimizzare l'incidenza di embolie e di scompenso cardiaco.
Le raccomandazioni - ampiamente condivise in letteratura - sulla scelta terapeutica, in senso strettamente aritmologico, si basano sull'alternativa tra[1]
- il controllo del ritmo (cioè il recupero e il mantenimento del ritmo sinusale con farmaci antiaritmici o l'ablazione transcatetere);
- il controllo della frequenza cardiaca con farmaci che regolano la conduzione degli stimoli atriali ai ventricoli associati alla terapia antitrombotica.
Numerosi studi randomizzati non hanno dimostrato beneficio sulla mortalità nei pazienti trattati con i farmaci antiaritmici finora in uso per il controllo del ritmo rispetto a quelli trattati solo per il controllo della frequenza[3][4][5][6].
A tutt'oggi non è noto se la strategia di controllo del ritmo con l'ablazione transcatetere migliori la mortalità rispetto al semplice controllo della frequenza cardiaca. È in corso uno studio randomizzato che mette a confronto l'ablazione con la terapia farmacologica[7].
La scelta sulla condotta terapeutica viene quindi personalizzata basandosi su vari fattori:
- l'età,
- la tolleranza emodinamica,
- l'entità dei sintomi,
- l'epoca di insorgenza della fibrillazione,
- la storia di recidive precedenti e la loro durata,
- l'elevata probabilità di recidiva,
- la reversibilità delle condizioni causali,
- la presenza e severità di cardiopatie strutturali sottostanti,
- le dimensioni degli atri e la presenza di rimodellamento strutturale,
- la tolleranza dei farmaci antiaritmici e anticoagulanti,
- le aspettative del paziente.
Epidemiologia
[modifica | modifica wikitesto]La fibrillazione atriale è la forma più diffusa di aritmia, dopo l'extrasistolia. L'1-2% della popolazione è affetta da fibrillazione atriale; probabilmente la prevalenza è però più vicina al 2%, tenendo conto del gran numero di casi non diagnosticati[8][9]. Gli uomini presentano una prevalenza superiore al sesso femminile. L'incidenza (il numero di nuovi casi per anno) è aumentata del 13% negli ultimi 20 anni. Il rischio di presentare fibrillazione atriale nel resto della vita, negli individui di 40 anni di età, è di circa il 25%.
Condizioni associate e fattori di rischio
[modifica | modifica wikitesto]Tutte le malattie cardiache e molte patologie extracardiovascolari possono essere associate, come fattore causale o come fattore di rischio o come conseguenza, alla fibrillazione atriale. In particolare molte di queste condizioni possono essere concomitanti: tale polimorbilità ha un effetto additivo nel determinismo dell'aritmia.
- Età: l'invecchiamento aumenta l'incidenza della fibrillazione atriale. La prevalenza dell'aritmia nella popolazione generale aumenta dallo 0,5-4,5% a 40-45 anni, al 5-10% a 45-50 anni al 10-15% a 80 anni di età, sfiorando il 18% nella popolazione di età uguale o superiore a 85 anni[10]. Il rischio di presentare fibrillazione atriale nel resto della vita è di circa il 25% negli individui di 40 anni di età[11][12];
- Ipertensione arteriosa[13];
- Scompenso cardiaco: è presente nel 30% dei pazienti con fibrillazione atriale. L'aritmia può essere causa di scompenso sia favorendo cronicamente una tachicardo-miopatia o causando un'insufficienza cardiaca acuta a causa dell'elevata frequenza ventricolare. Lo scompenso cardiaco può a sua volta provocare la fibrillazione atriale attraverso l'aumento del volume e della pressione atriale o per disfunzione valvolare secondaria o stimolando meccanismi neuroendocrini di adattamento[14];
- Valvulopatie: la fibrillazione atriale è presente nel 30% circa delle valvulopatie, più precocemente nella storia naturale della stenosi e dell'insufficienza mitralica, più tardivamente nelle valvulopatie aortiche;
- Cardiomiopatie idiopatiche: dilatativa, ipertrofica[15], restrittiva;
- Disfunzione del nodo del seno: in associazione alla fibrillazione atriale configura la sindrome bradi-tachi;
- Cardiopatie congenite: soprattutto i difetti del setto interatriale, il ventricolo singolo, la trasposizione delle grandi arterie dopo intervento di Mustard, dopo chirurgia secondo Fontan;
- Cardiopatia ischemica: è presente nel 20% dei pazienti con fibrillazione atriale;
- Disfunzioni della tiroide: possono causare fibrillazione atriale (anche come unico fattore causale) in ordine l'ipertiroidismo, l'ipotiroidismo e le disfunzioni subcliniche della ghiandola tiroide[16];
- Obesità: è presente nel 25% dei pazienti con fibrillazione atriale[17];
- Diabete mellito: è presente nel 20% dei pazienti con fibrillazione atriale;
- Broncopneumopatia cronica ostruttiva: è presente nel 10.15% dei pazienti con fibrillazione atriale;
- Embolia polmonare e ipertensione polmonare primitiva e secondaria;
- Malattia renale cronica: è presente nel 10-15% dei pazienti con fibrillazione atriale;
- Sindrome delle apnee notturne ostruttive[18];
- Consumo di alcool[19];
- Chirurgia cardio-toracica[20][21];
- Fumo di tabacco[22];
- Esercizio fisico vigoroso o prolungato (atleti)[23][24];
- Reperto ecocardiografico di dilatazione dell'atrio sinistro, diminuzione della funzione sistolica del ventricolo sinistro (valutata come Frazione di Eiezione), ispessimento delle pareti del ventricolo sinistro, aumento degli indici di pressione telediastolica del ventricolo sinistro[25];
- Aumento di alcuni indici bioumorali di flogosi (Proteina C-reattiva)[26] e di insufficienza ventricolare sinistra (pro-BNP)[27].
Classificazione
[modifica | modifica wikitesto]La classificazione e la nomenclatura delle varie forme di fibrillazione atriale si basa sul criterio della durata o degli interventi terapeutici o dell'associazione ad altre patologie[28]. Nomenclatura dei diversi tipi di fibrillazione atriale:
- Fibrillazione atriale di nuova insorgenza: fibrillazione documentata per la prima volta, indipendentemente dalla presenza di sintomi o da eventuali precedenti episodi non documentati.
- Fibrillazione atriale parossistica: fibrillazione che termina spontaneamente entro 48 ore o 7 giorni dall'insorgenza (a seconda delle linee guida: il limite di 48 ore è stato posto perché è considerato il massimo periodo di tempo che consente la cardioversione immediata con basso rischio embolico; il limite di 7 giorni è stato posto perché è il periodo in cui più frequentemente avviene la remissione spontanea dell'aritmia).
- Fibrillazione atriale persistente: fibrillazione atriale continua di durata superiore a 48 ore o a 7 giorni,(a seconda delle linee guida) o che è interrotta con cardioversione farmacologica o elettrica dopo questo limite.
- Fibrillazione atriale persistente di lunga durata: fibrillazione atriale continua di durata superiore a 12 mesi. Questa durata è importante perché correlato alla probabilità di successo della cardioversione o dell'ablazione trans catetere.
- Fibrillazione atriale permanente: il termine è usato quando paziente e medico decidono congiuntamente di accettare la fibrillazione atriale e desistere da ulteriori tentativi di ripristinare e mantenere il ritmo sinusale. Non si riferisce quindi alle caratteristiche fisiopatologiche dell'aritmia poiché la decisione dipende dalla malattia cardiaca sottostante, dai sintomi, dall'efficacia delle terapie e dalla preferenza del paziente e del medico.
- Fibrillazione atriale non valvolare: fibrillazione atriale in assenza di stenosi mitralica reumatica, di protesi valvolare meccanica o biologica o di riparazione della valvola mitralica (la distinzione da quella associata a malattia valvolare è importante per la scelta della terapia anticoagulante).
- Fibrillazione atriale silente (o asintomatica): fibrillazione atriale che non si associa a sintomi, indipendentemente da altre caratteristiche. Può essere diagnosticata a seguito di una complicanza correlata alla FA, come l'ictus ischemico o la tachicardiomiopatia, o incidentalmente con l'esecuzione di un elettrocardiogramma.
- Fibrillazione atriale secondaria: fibrillazione atriale in cui è possibile individuare la causa dell'aritmia o una condizione favorente, cardiaca o extracardiaca.
- Fibrillazione atriale primitiva o isolata (Lone atrial fibrillation): fibrillazione atriale non associata a patologia cardiovascolare, compresa l'ipertensione arteriosa, o altro fattore causale noto. La diagnosi è quindi di esclusione e richiede l'esecuzione delle indagini cliniche e strumentali indicate per il caso. In generale riguarda individui giovani, o con età< 60 anni, apparentemente sani. L'assenza di reperti patologici negli esami non invasivi non esclude completamente patologie pregresse o in atto. In biopsie multiple del miocardio atriale di questi pazienti sono frequenti alterazioni istologiche di tipo prevalentemente infiammatorio o fibrotico[29]
Elettrocardiogramma e diagnosi
[modifica | modifica wikitesto]

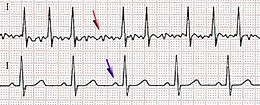
È caratterizzata all'elettrocardiogramma di superficie da assenza di onde P distinte (cioè assenza delle normali onde di attivazione atriale a fisiologica origine dal nodo del seno); sono presenti invece delle cosiddette onde f, di morfologia e voltaggio variabili, con un ciclo (o intervallo tra due attivazioni) variabile, ma comunque inferiore a 200 ms (corrispondente alla frequenza di 300 battiti/m) - per lo più la frequenza è di 400-600 battiti/m - che conferiscono un aspetto frastagliato all'isoelettrica. Gli intervalli RR (cioè gli intervalli tra due battiti corrispondenti all'attivazione elettrica dei ventricoli) sono completamente irregolari senza seguire uno schema ripetitivo. Per questo la fibrillazione atriale è stata chiamata aritmia totale. La durata minima per definire su un tracciato elettrocardiografico la fibrillazione atriale è di 30 sec.[30].
Data l'irregolarità dell'aritmia la frequenza cardiaca viene misurata come “frequenza ventricolare media”, cioè contando tutti i battiti (complessi QRS) presenti in un minuto e non estrapolando a partire da intervalli più brevi.
L'irregolarità dei battiti ventricolari determina l'irregolarità delle pulsazioni palpabili ai polsi arteriosi periferici (comunemente l'arteria radiale). Il sospetto diagnostico viene dalla presenza di un polso veloce e irregolare, ma la diagnosi deve essere elettrocardiografica. Anche il susseguirsi irregolare di extrasistoli può infatti mimare, in un polso veloce, una fibrillazione atriale.
La diagnosi differenziale con altre aritmie dovrebbe tenere in considerazione: la tachicardia sopraventricolare e il flutter atriale (che hanno cicli atriali in genere superiori a 200 ms) e il susseguirsi di ectopie (extrasistole), A volte intervalli RR molto brevi possono coprire nell'elettrocardiogramma il ritmo atriale: può essere necessario allora rallentare la conduzione atrio-ventricolare con manovre vagali o farmaci (adenosina, calcioantagonisti non idropiridinici) in modo da far emergere sul tracciato le onde f. A volte la somministrazione di farmaci antiaritmici può prolungare i cicli atriali (durata maggiore di 200 ms).
Fisiopatologia
[modifica | modifica wikitesto]La fibrillazione atriale è determinata dall'interazione di tre fattori:
- il trigger, lo stimolo elettrico che la inizia;
- il substrato, il tessuto miocardico atriale vulnerabile che ne permette l'inizio e il mantenimento;
- il contesto metabolico (soprattutto la concentrazione degli elettroliti) e neuroendocrino (simpatico e parasimpatico).
Nonostante i progressi della ricerca sperimentale e clinica, la fisiopatologia della fibrillazione atriale non è ancora stata completamente chiarita. La scoperta recente più importante è stata l'identificazione dei trigger (battiti ectopici) ad origine dalle vene polmonari da parte di Michel Haïssaguerre[31]. Si ritiene che, passando dalla forma parossistica a quella persistente, l'importanza del trigger ceda il posto al substrato (modificazioni del miocardio) nella patogenesi dell'aritmia[32] Sono state identificati, sia in modelli animali sia in setting clinici nell'uomo, tre meccanismi responsabili della fibrillazione atriale:
- meccanismo focale dovuto alla rapida scarica di un unico o multipli foci stabili e conduzione fibrillatoria nell'atrio;
- fronti d'onda multipli rientranti[33];
- rotori relativamente stabili che producono altri rotori transitori e conduzione fibrillatoria negli atri[34].
Questi diversi meccanismi possono essere correlati a substrati differenti e anche a particolari differenti fattori genetici o biomolecolari individuali[35] .
Predisposizione genetica
[modifica | modifica wikitesto]Alcune malattie ereditarie del cuore sono associate a elevata incidenza di fibrillazione atriale: la sindrome del QT lungo, la sindrome del QT breve, la sindrome di Brugada, la cardiomiopatia ipertrofica[36]. Sono state identificate anche forme familiari di fibrillazione atriale associate a mutazioni geniche. I geni implicati sono quello del peptide natriuretico atriale, il gene SCN5A del canale del sodio, del canale del potassio, loci vicini ai geni PITX2 e ZFHX3, il gene PRKAG[37][38].
Rimodellamento
[modifica | modifica wikitesto]Il tessuto atriale, una volta instauratasi la fibrillazione va incontro ad un "rimodellamento elettrico" e “strutturale”, cioè a modificazioni prima delle caratteristiche elettrofisiologiche e poi della struttura del miocardio. Queste modificazioni divengono via via maggiori e stabili in correlazione alla durata dell'aritmia, così da diminuire la probabilità di ripristinare il ritmo sinusale normale o di mantenerlo dopo la cardioversione. Infatti è ormai accettata la frase: «la fibrillazione atriale promuove la fibrillazione atriale» (‘'AF begets AF'’)[39].
Rimodellamento elettrico
[modifica | modifica wikitesto]Consiste in modificazioni elettrofisiologiche delle fibre muscolari miocardiche: accorciamento del periodo refrattario atriale effettivo (ERP), perdita dell'adattamento dell'ERP alla frequenza cardiaca, rallentamento della velocità di conduzione atriale, disomogeneità della velocità di conduzione e del l'ERP nelle varie fibre atriali, perdita dell'adattamento della durata del potenziale d'azione alla frequenza cardiaca[40]. Dal punto di vista molecolare, alla base di queste modificazioni ci sarebbero variazioni delle correnti ioniche di membrana indotte dalla fibrillazione atriale. In particolare sono state dimostrate diminuzione del ICaL Ito e Ikur, aumento di Ik1, IkACh e Iks. L'aumento del calcio intracellulare porta all'attivazione della Calcineurina Ca-dipendente e del sistema kinasi II Calcio/Calmodulina (le stesse vie sono coinvolte nell'apoptosi o morte cellulare[41]. È stata dimostrata anche l'iperfosforilazione della Connessina 43 con alterazione della conduzione del potenziale d'azione nelle giunzioni tra i miociti[42].
Rimodellamento strutturale
[modifica | modifica wikitesto]La fibrillazione atriale causa fibrosi interstiziale del tessuto atriale e, a sua volta, la fibrosi facilità il perpetuarsi della fibrillazione atriale. Questo circolo vizioso è stato dimostrato in modelli animali e nell'uomo. Biopsie dell'atrio hanno dimostrato fibrosi sia in cuori scompensati, sia nella fibrillazione atriale isolata; e la quantità di fibrosi aumenta con la durata dell'aritmia[43].
La fibrosi interstiziale dell'atrio sembra legata all'attivazione di due vie regolatorie: il sistema renina-angiotensina e il fattore di crescita TGF-
Alla base del rimodellamento elettrico e strutturale sembrano esserci anche altri due meccanismi: l'aumento dello stress ossidativo e l'intervento di fattori dell'infiammazione[45]. È stato dimostrato in modelli sperimentali di fibrillazione atriale l'aumento della ossido nitrico sintetasi endoteliale e della nicotinammide adenina dinucleotide fosfato ossidasi (NOX) che portano all'aumento di superossidi e perossidi, responsabili di attivazione di infiammazione, apoptosi e fibrosi[46]. Le stesse vie possono essere coinvolte nella regolazione dei canali ionici di membrana e nella regolazione del calcio intracellulare. Inoltre sono state correlate al tumor necrosis factor-
Caratteristiche emodinamiche
[modifica | modifica wikitesto]
Nel normale ritmo cardiaco, l'impulso generato dal nodo senoatriale causa la contrazione del muscolo cardiaco e permette il pompaggio del sangue. Nella fibrillazione atriale, gli impulsi elettrici che danno luogo alla contrazione degli atri si attivano in maniera totalmente caotica e frammentaria dando origine a multipli fronti d'onda e a contrazioni disorganizzate e frammentarie. Queste contrazioni del miocardio atriale sono inefficaci dal punto di vista emodinamico, per cui la funzione di pompa del cuore, esercitata principalmente dalle contrazioni ventricolari, perde il contributo della sistole atriale. In assenza di altre cardiopatie questo non incide in maniera rilevante sulla funzione di pompa, infatti il contributo della contrazione atriale si aggira intorno al 20-30% del volume telediastolico totale.
Tuttavia, la perdita della contrazione atriale, l'irregolarità e spesso l'accelerazione del battito e l'aumento della pressione di riempimento possono compromettere la funzione ventricolare sinistra, in maniera variabile, sotto sforzo, e la tolleranza agli sforzi può essere pertanto ridotta. Inoltre, la fibrillazione atriale è un importante fattore di rischio per lo stroke (ictus) ischemico. Circa un quinto degli stroke è dovuto a questa aritmia. Essa costituisce anche un fattore di rischio per una riduzione della capacità cognitiva, per le ospedalizzazioni ripetute, e in generale può determinare una riduzione della qualità di vita.
La mortalità nei pazienti affetti da fibrillazione atriale è doppia rispetto a quella dei pazienti non affetti. La terapia antitrombotica è l'unica ad aver dimostrato una riduzione della mortalità in questi pazienti[48].

.
Meccanismi elettrofisiologici
[modifica | modifica wikitesto]Secondo la teoria delle multiple wavelet, numerosissimi fronti d'onda vengono condotti nella parete atriale in modo caotico, e vanno incontro a fenomeni di fusione e interazione reciproca. Tali eventi portano al continuo annullamento di fronti d'onda e alla generazione di nuovi fronti, in modo altrettanto caotico. Questo meccanismo consente il perpetuarsi dell'aritmia.
Clinica
[modifica | modifica wikitesto]Sintomatologia
[modifica | modifica wikitesto]Un sintomo della FA è la palpitazione: il paziente avverte un senso soggettivo di battito irregolare, che si può accompagnare a mancanza d'aria o svenimenti quando la frequenza del battito ventricolare diventa particolarmente elevata. In casi particolarmente gravi, un paziente già portatore di cardiopatia può andare incontro a scompenso cardiaco. L'astenia, cioè la stanchezza fisica, è un sintomo sempre presente nella FA.
Terapia
[modifica | modifica wikitesto]- FA parossistica in soggetto sano: Nel soggetto sano il ripristino del ritmo sinusale (cardioversione) avviene spontaneamente nel 60% dei casi circa, nelle prime ore dopo l'episodio acuto. Se non c'è cardioversione spontanea, si può tentare la cardioversione farmacologica somministrando farmaci antiaritmici come propafenone, flecainide o, in caso di concomitante presenza di cardiopatie strutturali, soprattutto riduzione della contrattilità, amiodarone. Questo in quanto gli antiaritmici di classe Ic (propafenone e flecainide) causano un'importante riduzione della contrattilità.
- FA in cardiopatico che non mostra insufficienza cardiaca: la conversione a ritmo sinusale (ritmo normale) può avvenire tramite la somministrazione di propafenone o amiodarone, nel caso non si riuscisse ad ottenere un ritmo sinusale va programmata una cardioversione elettrica. Prima di sottoporre il paziente a cardioversione è opportuno - al fine di prevenire il distacco di trombi dagli atri, con conseguenti embolie - un adeguato trattamento anticoagulante, per esempio, con eparina, se l'aritmia è insorta da meno di 48 ore o con la terapia anticoagulante orale, usando il warfarin o l'acenocumarolo, in tutti gli altri casi[49].
- FA in soggetto con insufficienza cardiaca: il ripristino di un ritmo sinusale deve essere ricercato utilizzando la cardioversione elettrica esterna.
Se non si è potuto ottenere la cardioversione di una FA, oppure si è di fronte a una FA permanente, la terapia dovrà mirare al controllo della frequenza cardiaca con farmaci come la digitale, i betabloccanti, il verapamil o il diltiazem mentre il rischio di tromboembolia verrà ridotto con l'utilizzo di anticoagulanti orali, che fino ad ora erano rappresentati dal warfarin e l'acenocumarolo. Tali farmaci però richiedono il controllo periodico del livello di anticoagulazione attraverso dei prelievi di sangue.
Recentemente sono stati approvati dei farmaci anticoagulanti, che non necessiteranno più dei controlli ematologici; tali nuovi farmaci, dabigatran, rivaroxaban e apixaban, sono stati valutati, rispettivamente, nei seguenti studi: RE-LY, ROCKET-AF e ARISTOTELE[50] [51] [52].
È intuibile che la semplificazione nel controllo della terapia cronica, è il punto di forza di tali nuove sostanze. Le indicazioni al loro utilizzo, al momento, sono fondamentalmente, la prevenzione dello stroke nella fibrillazione atriale cronica e la prevenzione del tromboembolismo (trombosi venosa profonda ed embolia polmonare nella chirurgia ortopedica).
In alcuni casi, quando sia danneggiato il fascio di conduzione verso i ventricoli e quindi sia particolarmente bassa la frequenza cardiaca, si provvederà all'impianto di un pacemaker definitivo. In casi di FA cronica o recidivante in pazienti selezionati, nei quali non si riesce a mantenere nel tempo un ritmo sinusale, si propone, in questi ultimi anni, la ablazione transcatetere con radiofrequenza: questa metodica attualmente è efficace in circa il 70% dei casi.
Tra i nuovi farmaci, per la cardioversione farmacologica, vi è il vernakalant, approvato per l'uso in Europa nel 2010[53].
Note
[modifica | modifica wikitesto]- ^ a b (EN) January CT et al., 2014 AHA/ACC/HR, guideline for the management of patients with atrial fibrillation: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society, in J Am Coll Cardiol, n. 64, 2014, pp. 2246-2280. URL consultato il 27 ottobre 2018.
- ^ (EN) David Brieger et al., National Heart Foundation of Australia and the Cardiac Society of Australia and New Zealand: Australian Clinical Guidelines for the Diagnosis and Management of Atrial Fibrillation 2018, vol. 27, n. 10, 2018, pp. 1209-1266. URL consultato il 27 ottobre 2018.
- ^ Roy D et al., Atrial Fibrillation and Congestive Heart Failure Investigators. Rhythm control versus rate control for atrial fibrillation and heart failure, in N Engl J Med, n. 358, 2008, pp. 2667–2677, DOI:10.1056/NEJMoa0708789, PMID 18565859.
- ^ Wyse DG et al., Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation, in N Engl J Med, n. 347, 2002, pp. 1825–1833, DOI:10.1056/NEJMoa021328, PMID 12466506.
- ^ Carlsson J et al., Randomized trial of rate-control versus rhythm-control in persistent atrial fibrillation: the Strategies of Treatment of Atrial Fibrillation (STAF) study, in J Am Coll Cardiol, n. 41, 2003, pp. pagg.1690-1696, DOI:10.1016/S0735-1097(03)00332-2, PMID 12767648.
- ^ Hohnloser SH, Kuck KH e Lilienthal J, Rhythm or rate control in atrial fibrillation—Pharmacological Intervention in Atrial Fibrillation (PIAF): a randomised trial, in Lancet, n. 356, 2000, pp. 1789–1794, DOI:10.1016/S0140-6736(00)03230-X, PMID 11117910.
- ^ Catheter Ablation versus Anti-arrhythmic Drug Therapy for Atrial Fibrillation Trial (CABANA), su cabanatrial.org. URL consultato il 17 agosto 2015 (archiviato dall'url originale il 5 settembre 2015).
- ^ Kirchhof P et al., Outcome parameters for trials in atrial fibrillation: executive summary. Recommendations from a consensus conference organized by the German Atrial Fibrillation Competence NETwork (AFNET) and the European Heart Rhythm Association (EHRA), in Eur Heart J, n. 28, 2007, pp. 2803-2817, DOI:10.1093/eurheartj/ehm358, PMID 17897924.
- ^ Stewart S et al., Population prevalence, incidence, and predictors of atrial fibrillation in the Renfrew/Paisley study, in Heart, n. 86, 2001, pp. 516–521, DOI:10.1136/heart.86.5.516, PMID 11602543.
- ^ (EN) Heeringa, et al., Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study [collegamento interrotto] (abstract), in European Heart Journal, n. 27, marzo 2006, pp. 949-953. URL consultato il 9 gennaio 2009.
- ^ Lloyd-Jones DM et al., Lifetime risk for development of atrial fibrillation: the Framingham Heart Study, in Circulation, n. 110, 2004, pp. 1042–1046, DOI:10.1161/01.CIR.0000140263.20897.42, PMID 15313941.
- ^ Heeringa J et al., Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study, in Eur Heart J, n. 27, 2006, pp. 949–953, DOI:10.1161/01.CIR.0000140263.20897.42, PMID 15313941.
- ^ Benjamin EJ et al., Independent risk factors for atrial fibrillation in a population-based cohort: the Framingham Heart Study, in JAMA, vol. 271, 1994, pp. 840–4, DOI:10.1001/jama.1994.03510350050036, PMID 8114238.
- ^ Nieuwlaat R et al., Atrial fibrillation management: a prospective survey in ESC member countries: the Euro Heart Survey on Atrial Fibrillation, in Eur Heart J, vol. 26, 2005, pp. 2422–2434, DOI:10.1093/eurheartj/ehi505, PMID 16204266.
- ^ Gersh BJ et al., 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of CardiologyFoundation/AmericanHeartAssociationTaskForce on Practice Guidelines, in J Am Coll Cardiol, n. 58, 2011, pp. e212–60, DOI:10.1016/j.jtcvs.2011.10.020, PMID 22093723.
- ^ Cappola AR et al., Thyroid status, cardiovascular risk, and mortality in older adults, in JAMA, n. 295, 2006, pp. 1033–41, DOI:10.1001/jama.295.9.1033, PMID 16507804.
- ^ Frost L et al., Overweight and obesity as risk factors for atrial fibrillation or flutter: the Danish Diet, Cancer, and Health Study, in Am J Med 2005, n. 118, pp. 489–95, DOI:10.1016/j.amjmed.2005.01.031, PMID 15866251.
- ^ AS. Gami et al., Obstructive sleep apnea, obesity, and the risk of incident atrial fibrillation., in J Am Coll Cardiol, vol. 49, n. 5, febbraio 2007, pp. 565-71, DOI:10.1016/j.jacc.2006.08.060, PMID 17276180.
- ^ S. Kodama et al., Alcohol consumption and risk of atrial fibrillation: a meta-analysis., in J Am Coll Cardiol, vol. 57, n. 4, gennaio 2011, pp. 427-36, DOI:10.1016/j.jacc.2010.08.641, PMID 21251583.
- ^ JP. Mathew et al., A multicenter risk index for atrial fibrillation after cardiac surgery., in JAMA, vol. 291, n. 14, aprile 2004, pp. 1720-9, DOI:10.1001/jama.291.14.1720, PMID 15082699.
- ^ LD. Hillis et al., 2011 ACCF/AHA Guideline for Coronary Artery Bypass Graft Surgery. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Developed in collaboration with the American Association for Thoracic Surgery, Society of Cardiovascular Anesthesiologists, and Society of Thoracic Surgeons., in J Am Coll Cardiol, vol. 58, n. 24, dicembre 2011, pp. e123-210, DOI:10.1016/j.jacc.2011.08.009, PMID 22070836.
- ^ J. Heeringa et al., Cigarette smoking and risk of atrial fibrillation: the Rotterdam Study., in Am Heart J, vol. 156, n. 6, dicembre 2008, pp. 1163-9, DOI:10.1016/j.ahj.2008.08.003, PMID 19033014.
- ^ A. Aizer et al., Relation of vigorous exercise to risk of atrial fibrillation., in Am J Cardiol, vol. 103, n. 11, giugno 2009, pp. 1572-7, DOI:10.1016/j.amjcard.2009.01.374, PMID 19463518.
- ^ L. Mont et al., Long-lasting sport practice and lone atrial fibrillation., in Eur Heart J, vol. 23, n. 6, marzo 2002, pp. 477-82, DOI:10.1053/euhj.2001.2802, PMID 11863350.
- ^ WB. Kannel et al., Prevalence, incidence, prognosis, and predisposing conditions for atrial fibrillation: population-based estimates., in Am J Cardiol, vol. 82, 8A, ottobre 1998, pp. 2N-9N, PMID 9809895.
- ^ a b RJ. Aviles et al., Inflammation as a risk factor for atrial fibrillation., in Circulation, vol. 108, n. 24, dicembre 2003, pp. 3006-10, DOI:10.1161/01.CIR.0000103131.70301.4F, PMID 14623805.
- ^ KK. Patton et al., N-terminal pro-B-type natriuretic peptide is a major predictor of the development of atrial fibrillation: the Cardiovascular Health Study., in Circulation, vol. 120, n. 18, novembre 2009, pp. 1768-74, DOI:10.1161/CIRCULATIONAHA.109.873265, PMID 19841297.
- ^ A.Raviele, Linee guida AIAC per la gestione e il trattamento della fibrillazione atriale. Aggiornamento 2013 (PDF), su aiac.it. URL consultato il 23 ottobre 2015.
- ^ A. Frustaci et al., Histological substrate of atrial biopsies in patients with lone atrial fibrillation., in Circulation, vol. 96, n. 4, agosto 1997, pp. 1180-4, PMID 9286947.
- ^ P. Kirchhof et al., Outcome parameters for trials in atrial fibrillation: recommendations from a consensus conference organized by the German Atrial Fibrillation Competence NETwork and the European Heart Rhythm Association., in Europace, vol. 9, n. 11, novembre 2007, pp. 1006-23, DOI:10.1093/europace/eum191, PMID 17897925.
- ^ M. Haïssaguerre et al., Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins., in N Engl J Med, vol. 339, n. 10, settembre 1998, pp. 659-66, DOI:10.1056/NEJM199809033391003, PMID 9725923.
- ^ TH. Everett, JE. Olgin, Atrial fibrosis and the mechanisms of atrial fibrillation., in Heart Rhythm, vol. 4, 3 Suppl, marzo 2007, pp. S24-7, DOI:10.1016/j.hrthm.2006.12.040, PMID 17336879.
- ^ KT. Konings et al., High-density mapping of electrically induced atrial fibrillation in humans., in Circulation, vol. 89, n. 4, aprile 1994, pp. 1665-80, PMID 8149534.
- ^ SM. Narayan et al., Treatment of atrial fibrillation by the ablation of localized sources: CONFIRM (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation) trial., in J Am Coll Cardiol, vol. 60, n. 7, agosto 2012, pp. 628-36, DOI:10.1016/j.jacc.2012.05.022, PMID 22818076.
- ^ (EN) AM. Kim et al., Role of atrial substrate and spatiotemporal organization in atrial fibrillation., in Heart Rhythm, vol. 6, 8 Suppl, agosto 2009, pp. S1-7, DOI:10.1016/j.hrthm.2009.02.010, PMID 19631905.
- ^ P. Kirchhof et al., Early and comprehensive management of atrial fibrillation: executive summary of the proceedings from the 2nd AFNET-EHRA consensus conference 'research perspectives in AF'., in Eur Heart J, vol. 30, n. 24, dicembre 2009, pp. 2969-77c, DOI:10.1093/eurheartj/ehp235, PMID 19535417.
- ^ DM. Hodgson-Zingman et al., Atrial natriuretic peptide frameshift mutation in familial atrial fibrillation., in N Engl J Med, vol. 359, n. 2, luglio 2008, pp. 158-65, DOI:10.1056/NEJMoa0706300, PMID 18614783.
- ^ DF. Gudbjartsson et al., A sequence variant in ZFHX3 on 16q22 associates with atrial fibrillation and ischemic stroke., in Nat Genet, vol. 41, n. 8, agosto 2009, pp. 876-8, DOI:10.1038/ng.417, PMID 19597491.
- ^ MC. Wijffels et al., Atrial fibrillation begets atrial fibrillation. A study in awake chronically instrumented goats., in Circulation, vol. 92, n. 7, ottobre 1995, pp. 1954-68, PMID 7671380.
- ^ CA. Morillo et al., Chronic rapid atrial pacing. Structural, functional, and electrophysiological characteristics of a new model of sustained atrial fibrillation., in Circulation, vol. 91, n. 5, marzo 1995, pp. 1588-95, PMID 7867201.
- ^ S. Neef, LS. Maier, Novel aspects of excitation-contraction coupling in heart failure., in Basic Res Cardiol, vol. 108, n. 4, luglio 2013, p. 360, DOI:10.1007/s00395-013-0360-2, PMID 23740218.
- ^ SM. Chaldoupi et al., The role of connexin40 in atrial fibrillation., in Cardiovasc Res, vol. 84, n. 1, ottobre 2009, pp. 15-23, DOI:10.1093/cvr/cvp203, PMID 19535379.
- ^ B. Burstein, S. Nattel, Atrial fibrosis: mechanisms and clinical relevance in atrial fibrillation., in J Am Coll Cardiol, vol. 51, n. 8, febbraio 2008, pp. 802-9, DOI:10.1016/j.jacc.2007.09.064, PMID 18294563.
- ^ D. Rahmutula et al., Molecular basis of selective atrial fibrosis due to overexpression of transforming growth factor-
β 1., in Cardiovasc Res, vol. 99, n. 4, settembre 2013, pp. 769-79, DOI:10.1093/cvr/cvt074, PMID 23612580. - ^ SN. Reilly et al., Atrial sources of reactive oxygen species vary with the duration and substrate of atrial fibrillation: implications for the antiarrhythmic effect of statins., in Circulation, vol. 124, n. 10, settembre 2011, pp. 1107-17, DOI:10.1161/CIRCULATIONAHA.111.029223, PMID 21844076.
- ^ JY. Youn et al., Oxidative stress in atrial fibrillation: an emerging role of NADPH oxidase., in J Mol Cell Cardiol, vol. 62, settembre 2013, pp. 72-9, DOI:10.1016/j.yjmcc.2013.04.019, PMID 23643589.
- ^ J. Kornej et al., The emerging role of biomarkers in atrial fibrillation., in Can J Cardiol, vol. 29, n. 10, ottobre 2013, pp. 1181-93, DOI:10.1016/j.cjca.2013.04.016, PMID 23962731.
- ^ (EN) [Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC)], Guidelines for the management of atrial fibrillation, in European Heart Journal, n. 31, 2010, pp. 2369-2429, DOI:10.1093/eurheartj/ehq278.
- ^ Eugene Braunwald, Peter Libby, Robert O. Bonow, Douglas P. Zipes, Douglas L. Mann, Braunwald's Heart Disease. A textbook of cardiovascular medicine, 8ª ed., Saunders Elsevier, 2008, ISBN 978-1-4160-4105-4.
- ^ AR. Kansal, M. Sharma; C. Bradley-Kennedy; A. Clemens; BU. Monz; S. Peng; N. Roskell; SV. Sorensen, Dabigatran versus rivaroxaban for the prevention of stroke and systemic embolism in atrial fibrillation in Canada. Comparative efficacy and cost-effectiveness., in Thromb Haemost, vol. 108, n. 4, settembre 2012, pp. 672-82, DOI:10.1160/TH12-06-0388, PMID 22898892.
- ^ S. Deitelzweig, A. Amin; Y. Jing; D. Makenbaeva; D. Wiederkehr; J. Lin; J. Graham, Medical cost reductions associated with the usage of novel oral anticoagulants vs warfarin among atrial fibrillation patients, based on the RE-LY, ROCKET-AF, and ARISTOTLE trials., in J Med Econ, vol. 15, n. 4, 2012, pp. 776-85, DOI:10.3111/13696998.2012.680555, PMID 22449118.
- ^ J. Steffel, E. Braunwald, Novel oral anticoagulants: focus on stroke prevention and treatment of venous thrombo-embolism., in Eur Heart J, vol. 32, n. 16, agosto 2011, pp. 1968-76, 1976a, DOI:10.1093/eurheartj/ehr052, PMID 21421599.
- ^ BRINAVESS (vernakalant) for Infusion Approved in the European Union for Rapid Conversion of Recent Onset Atrial Fibrillation, su merck.com, Merck & Co., Inc., 1º settembre 2010. URL consultato il 28 settembre 2010 (archiviato dall'url originale il 28 settembre 2010).
Bibliografia
[modifica | modifica wikitesto]- Rowlands DJ, Interpretazione dell'elettrocardiogramma, Pro.Med. Editore, 2004, ISBN 978-88-6521-011-6.
- Zipes, Libby & Bonow Mann, Braunwald's Heart Disease: A Textbook of Cardiovascular Medicine, 10th Edition, Saunders, 2014, ISBN 978-1-4557-5133-4.
- Issa, Miller & Zipes, Clinical Arrhythmology and Electrophysiology: A Companion to Braunwald's Heart Disease, Expert Consult - Online and Print, 2nd Edition, Saunders, 2012, ISBN 978-1-4557-1274-8.
- Mark E. Josephson, Josephson's Clinical Cardiac Electrophysiology, 5 ed, Lippincott Williams&Wilki, 2015, ISBN 978-1-4511-8741-0.
- Laurence Brunton e Randa Hilal Dandan, Goodman & Gilman's. The pharmacological basis of therapy, McGraw-Hill Education, 2011, ISBN 978-0-07-162442-8.
Voci correlate
[modifica | modifica wikitesto]- Ablazione della fibrillazione atriale
- Aritmia
- Cardioversione
- Classificazione di Lown
- Fenomeno di Ashman
- Flutter atriale
- Nuovi anticoagulanti orali
- Sistema di conduzione del cuore
- Tecnologia AFIB
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su fibrillazione atriale
Wikimedia Commons contiene immagini o altri file su fibrillazione atriale
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Mark L. Entman, atrial fibrillation, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Associazione Italiana di Aritmologia e Cardiostimolazione(AIAC), su aiac.it.
- Heart Rhythm Society, su hrsonline.org.
| Controllo di autorità | Thesaurus BNCF 23217 · LCCN (EN) sh85009546 · GND (DE) 4278966-7 · BNF (FR) cb122616614 (data) · J9U (EN, HE) 987007295754905171 · NDL (EN, JA) 01103770 |
|---|