Tegafur
| Tegafur | |
|---|---|
 | |
 | |
| Nome IUPAC | |
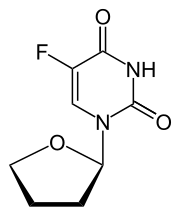
| (RS)-5-Fluoro-1-(tetrahydrofuran-2-yl)pyrimidine-2,4(1H,3H)-dione | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C8H9FN2O3 |
| Massa molecolare (u) | 200.16 g/mol |
| Numero CAS | |
| Numero EINECS | 241-846-2 |
| Codice ATC | L01 |
| PubChem | 288216 CID 288216 |
| DrugBank | DBDB09256 |
| SMILES | C1CC(OC1)N2C=C(C(=O)NC2=O)F |
| Dati farmacologici | |
| Modalità di somministrazione | Endovenosa, orale |
| Dati farmacocinetici | |
| Legame proteico | 30-50% |
| Metabolismo | Epatico |
| Emivita | 5-14 ore |
| Escrezione | Renale |
| Indicazioni di sicurezza | |
Tegafur è un profarmaco, un chemioterapico fluorouracilico, che nell'organismo viene trasformato a 5-fluorouracile (5-FU), un analogo pirimidinico alogenato ad attività antineoplastica. La sua azione si esplica interferendo con la sintesi sia del DNA che dell'RNA.
Chimica
[modifica | modifica wikitesto]Si presenta nella forma di cristalli, facilmente solubili in acqua calda, in etanolo e in dimetilformamide e praticamente insolubili nell'etere. La sostanza, in soluzione acquosa acida, assorbe nell'ultravioletto (UV) alla lunghezza d'onda di 270 nm.
Farmacodinamica
[modifica | modifica wikitesto]Tegafur appartenente alla classe delle fluoropirimidine ed esercita la sua azione antimetabolita interferendo con il metabolismo degli acidi nucleici, inibendo gli enzimi timidilato-sintetasi e timidilato-chinasi.[1]
Farmacocinetica
[modifica | modifica wikitesto]A seguito di somministrazione per via orale il farmaco viene adeguatamente assorbito dal tratto gastrointestinale.
In seguito alla somministrazione di dosi orali rispettivamente pari a 0,25, 0,50, 0,75 e 1 g/m2, si ottengono entro 2-4 ore (Tmax) picchi plasmatici (Cmax) di 25, 35, 40 e 50 µg/ml.
La somministrazione endovenosa prolunga l'emivita plasmatica (da 6 a 16 ore) e rallenta la biotrasformazione nel metabolita attivo 5-fluorouracile.
Il farmaco ha un volume di distribuzione di 0,4-0,8 l/kg e un'emivita plasmatica di 5-14 ore.
Tegafur si caratterizza per un legame con le proteine plasmatiche compreso tra il 30% e il 50%.
La ghiandola epatica è la sede di biotrasformazione di tegafur a farmaco attivo.
Oltre a 5-fluorouracile sono stati identificati altri metaboliti e tra essi: il deidrotegafur, il trans-3'-idrossitegafur, il trans-4'-idrossitegafur, il cis-4'-tegafur e il g-butirrolattone.
L'eliminazione del composto dall'organismo avviene prevalentemente per via renale, e nelle urine si trova solo il 20% del farmaco in forma immodificata.
Tegafur attraversa la barriera ematoencefalica e può essere dosato nel liquido cefalo-rachidiano.
Tossicologia
[modifica | modifica wikitesto]La DL50 per via orale è di 930 mg/kg peso corporeo nel topo e di 1970 mg/kg nel ratto; per via intramuscolare è di 920 mg/kg nel topo e di 1390 mg/kg nel ratto; per via intraperitoneale è di 750 mg/kg nel topo maschio, di 640 mg/kg nel topo femmina e di 1280 mg/kg nel ratto maschio. Negli animali da laboratorio il farmaco è risultato teratogeno e cancerogeno.
Usi clinici
[modifica | modifica wikitesto]Tegafur viene impiegato nel trattamento di varie neoplasie maligne tra cui il carcinoma della mammella,[2] della vescica, del fegato[3][4] e del pancreas, dei polmoni,[5] dello stomaco,[6] del colon-retto,[7][8][9][10][11][12] della prostata[13] ed infine dell'adenocarcinoma del tratto gastrointestinale. L'utilizzo del composto avviene quasi sempre in associazione con altri chemioterapici.
Effetti collaterali e indesiderati
[modifica | modifica wikitesto]Gli effetti avversi sono sostanzialmente gli stessi del fluorouracile, con una mielodepressione meno grave e una più frequente neurotossicità a livello centrale.[14] La tossicità gastrointestinale indotta da tegafur è un fattore limitante per il dosaggio. Da studi su animali è emerso che la somministrazione concomitante di uracile e tegafur riduce la cardiotossicità e la neurotossicità di quest'ultimo. In letteratura medica sono segnalati casi di polmonite eosinofila secondaria al trattamento con l'antineoplastico.[15]
Controindicazioni
[modifica | modifica wikitesto]Tegafur è controindicato nei soggetti con ipersensibilità nota al principio attivo oppure ad uno qualsiasi degli eccipienti utilizzati nella forma farmaceutica. È inoltre controindicato nelle donne in stato di gravidanza, durante l'allattamento oppure in presenza di gravi infezioni. Il composto deve essere somministrato con cautela nei soggetti defedati o affetti da grave insufficienza epatica, renale o midollare.
Dosi terapeutiche
[modifica | modifica wikitesto]Le dosi di farmaco usualmente impiegate variano da 1 a 1,5 g/m2 di superficie corporea al giorno per via endovenosa, per cicli fino a 21 giorni, da ripetere ad intervalli di 4 settimane.
Tegafur può essere somministrato anche per via orale in dosi che possono raggiungere i 1200 mg/die.[16][17]
Note
[modifica | modifica wikitesto]- ^ F. Tanaka, UFT (tegafur and uracil) as postoperative adjuvant chemotherapy for solid tumors (carcinoma of the lung, stomach, colon/rectum, and breast): clinical evidence, mechanism of action, and future direction., in Surg Today, vol. 37, n. 11, 2007, pp. 923-43, DOI:10.1007/s00595-007-3578-5, PMID 17952521.
- ^ T. Nakayama, S. Noguchi, Therapeutic usefulness of postoperative adjuvant chemotherapy with Tegafur-Uracil (UFT) in patients with breast cancer: focus on the results of clinical studies in Japan., in Oncologist, vol. 15, n. 1, 2010, pp. 26-36, DOI:10.1634/theoncologist.2009-0255, PMID 20080863.
- ^ T. Ishikawa, Chemotherapy with enteric-coated tegafur/uracil for advanced hepatocellular carcinoma., in World J Gastroenterol, vol. 14, n. 18, Mag 2008, pp. 2797-801, PMID 18473401.
- ^ K. Tanabe, K. Taura; E. Hatano; Y. Koyama; Y. Takada; S. Uemoto, [Complete remission of hepatocellular carcinoma with multiple lung metastases by oral administration of tegafur/uracil]., in Gan To Kagaku Ryoho, vol. 40, n. 8, Ago 2013, pp. 1077-80, PMID 23986055.
- ^ CJ. Langer, The role of tegafur/uracil in pulmonary malignancy., in Drugs, 58 Suppl 3, 1999, pp. 71-5, PMID 10711844.
- ^ H. Takiuchi, JA. Ajani, Uracil-tegafur in gastric carcinoma: a comprehensive review., in J Clin Oncol, vol. 16, n. 8, Ago 1998, pp. 2877-85, PMID 9704742.
- ^ PM. Hoff, Y. Lassere; R. Pazdur, Tegafur/uracil + calcium folinate in colorectal cancer: double modulation of fluorouracil., in Drugs, 58 Suppl 3, 1999, pp. 77-83, PMID 10711845.
- ^ M. Fujii, [Tegafur.uracil for treatment of colorectal cancer]., in Nihon Rinsho, 61 Suppl 7, Set 2003, pp. 349-51, PMID 14574910.
- ^ S. Ward, E. Kaltenthaler; J. Cowan; N. Brewer, Clinical and cost-effectiveness of capecitabine and tegafur with uracil for the treatment of metastatic colorectal cancer: systematic review and economic evaluation., in Health Technol Assess, vol. 7, n. 32, 2003, pp. 1-93, PMID 14604497.
- ^ R. Labianca, GD. Beretta; S. Mosconi; L. Milesi, The role of uracil-tegafur (UFT) in elderly patients with colorectal cancer., in Crit Rev Oncol Hematol, vol. 52, n. 1, Ott 2004, pp. 73-80, DOI:10.1016/j.critrevonc.2004.06.001, PMID 15363468.
- ^ J. Kauh, P. Johnstone, Commentary on Wang et al., Pre-operative chemotherapy with oral tegafur-uracil and leucovorin for rectal cancer (J Surg Oncol 89: 256-263)., in J Surg Oncol, vol. 90, n. 2, Mag 2005, pp. 106-7, DOI:10.1002/jso.20262, PMID 15844186.
- ^ SE. Ward, E. Kaltenthaler; J. Cowan; M. Marples; B. Orr; MT. Seymour, The clinical and economic benefits of capecitabine and tegafur with uracil in metastatic colorectal cancer., in Br J Cancer, vol. 95, n. 1, Lug 2006, pp. 27-34, DOI:10.1038/sj.bjc.6603215, PMID 16804526.
- ^ N. Kobayashi, K. Yoshida; T. Takahashi; H. Saitoh; K. Tari; I. Satake; S. Kojima; T. Tsujii; T. Negishi; S. Horiuchi, [Effect of tegafur administration combined with hormonal therapy in patients with newly diagnosed stage D prostatic cancer]., in Hinyokika Kiyo, vol. 36, n. 7, Lug 1990, pp. 793-800, PMID 2239576.
- ^ A. Ribas, E. Gallardo; R. Vera; S. Casado; R. Vidal; J. Bellmunt, Life-threatening toxicity of oral tegafur-uracil (UFT) plus leucovorin., in Clin Oncol (R Coll Radiol), vol. 9, n. 4, 1997, pp. 269-70, PMID 9315406.
- ^ I. Nagahiro, M. Miyamoto; H. Sugiyama; T. Kawai; K. Toda; T. Nobuhisa; Y. Endou; T. Watanabe; Y. Matsumoto; N. Watanabe; K. Kai, [A case of drug-induced eosinophilic pneumonia due to tegafur-uracil(UFT®)]., in Gan To Kagaku Ryoho, vol. 38, n. 10, Ott 2011, pp. 1679-82, PMID 21996966.
- ^ R. Jones, C. Twelves, Oral uracil-tegafur: an alternative to intravenous 5-fluorouracil?, in Expert Opin Pharmacother, vol. 2, n. 9, Set 2001, pp. 1495-505, DOI:10.1517/14656566.2.9.1495, PMID 11585027.
- ^ K. Wellington, KL. Goa, Oral tegafur/uracil., in Drugs Aging, vol. 18, n. 12, 2001, pp. 935-48; discussion 949-50, PMID 11888348.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Tegafur
Wikimedia Commons contiene immagini o altri file su Tegafur