二 フッ化 二 酸素
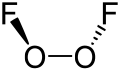
|

|
dioxygen difluoride | |
fluorooxy hypofluorite | |
| FOOF | |
| CAS |
7783-44-0 |
| PubChem | 123257 |
| ChemSpider | 109870 |
| ChEBI | |
| Gmelin |
1570 |
| |
| |
| O2F2 | |
| モル |
69.996 g mol−1 |
|
-154 °C, 119 K, -245 °F | |
|
-57 °C, 216 K, -71 °F ( | |
フッ | |
合成 [編集 ]
構造 [編集 ]
O2F2

反応 性 [編集 ]
また、ウラン
出典 [編集 ]
- ^ Kirshenbaum, A. D.; Grosse, A. V. (1959), “Ozone Fluoride or Trioxygen Difluoride, O3F2”, Journal of the American Chemical Society 81 (6): 1277, doi:10.1021/ja01515a003
- ^ a b Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, Academic Press, ISBN 0-12-352651-5
- ^ Ruff, O.; Mensel, W. (1933). “Neue Sauerstofffluoride: O2F2 und OF”. Zeitschrift für anorganische und allgemeine Chemie 211 (1-2): 204-208. doi:10.1002/zaac.19332110122.
- ^ Bridgeman, A. J.; Rothery, J. (1999), “Bonding in mixed halogen and hydrogen peroxides”, Journal of the Chemical Society, Dalton Transactions 1999 (22): 4077-4082, doi:10.1039/a904968a
- ^ Streng, A. G. (1963), “The Chemical Properties of Dioxygen Difluoride”, Journal of the American Chemical Society 85 (10): 1380-1385, doi:10.1021/ja00893a004
- ^ Solomon, I. J.; et al. (1964), “New Dioxygenyl Compounds”, Inorganic Chemistry 3 (3): 457, doi:10.1021/ic50013a036
- ^ Atwood, D. A. (2006), “Fluorine: Inorganic Chemistry”, Encyclopedia of Inorganic Chemistry, John Wiley & Sons, doi:10.1002/0470862106.ia076

![{\displaystyle {\ce {{2O2F2}+2PF5->\ {2[O2]^{+}[PF6]^{-}}+F2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/165976174992525b6a5b6af7aa450412f67a6499)