Hapticiteit
De term hapticiteit wordt gebruikt in de beschrijving van het type binding in de coördinatiechemie tussen een centraal atoom, meestal een metaal, en een aaneengesloten groep atomen van een ligand. De hapticiteit van een ligand wordt met het Griekse teken 'eta',
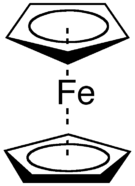
Geschiedenis
bewerkenDe noodzaak voor een aanvulling op de nomenclatuur voor organometaalverbindingen wordt in het midden van de jaren 50 van de 20e eeuw duidelijk. Dunitz, Orgel, and Rich beschreven in die periode op basis van Röntgendiffractie de structuur van de "Sandwichverbinding" ferroceen[1] waarin een ijzeratoom als het beleg in een sandwich tussen twee evenwijdige cyclopentadienylringen geplakt zit. Cotton stelde later de term hapticiteit voor. Het woord is afgeleid van het Griekse haptein, vastmaken.[2] In de naamgeving wordt "hapto" voor de naam van het alkeen (meestal gaat het om alkenen) geplaatst. Bovendien werd voorgesteld de
Historisch belangrijke verbindingen waarin de liganden via hapticiteit beschreven worden
bewerken- Ferroceen - bis(
η 5-cyclopentadienyl)ijzer - Uranoceen - bis(
η 8-1,3,5,7-cyclooctatetraeen)uranium - W(CO)3(PPri3)2(
η 2-H2 ) - de eerste gesynthetiseerde verbinding waarin een diwaterstofligand optreedt.[3][4] - IrCl(CO)[P(C6H5)3]2(
η 2-O2) - het dizuurstofderivaat van Vaska's complex dat ontstaat bij reversibele reactie met dizuurstof.
Voorbeelden
bewerkenDe notatievorm met de
- Complexen die eigenlijk gevormd worden via de zijkant van een
σ -binding zoals deze optreedt vanuit H2: - Complexen vanuit liganden met meervoudige bindingen zoals etheen in Zeise's zout, waarin de binding gerealiseerd wordt via de bindende
π -elektronen:- K[PtCl3(
η 2-C2H4)].H2O
- K[PtCl3(
- Aan de vorige groep verwante complexen waarin een
π -ligand als brug optreedt tussen verschillende metaalatomen:
- Opmerking: in brugvormende liganden kunnen ook andere manieren van overbrugging voorkomen dan via
η -binding, bijvoorbeeldκ 1,κ 1, zoals in (Me3SiCH2)3V(μ -N2-κ 1(N),κ 1(N'))V(CH2SiMe3)3 waarin het distikstofmolecuul via zijn twee uiteinden aan de metaalatomen gekoppeld is (zie ook Hapticiteit en Denticiteit).
- Opmerking: in brugvormende liganden kunnen ook andere manieren van overbrugging voorkomen dan via
- Die binding vanuit
π -systemen kan over verschillende atomen gespreid zijn. Naast het al eerder genoemde etheen kunnen ook allylgroepen, 1,3-butadieen, cyclopentadieenderivaten en benzeen hun elektronen delen in coördinatieverbindingen. - De complexvorming kan soms op gespannen voet lijken te staan met de 18-elektronenregel maar verklaarbaar zijn vanuit ongebruikelijke hapticiteiten:
- In het complex met 18-valentie-elektronen (
η 5-C5H5)Fe(η 1-C5H5)(CO)2 komt éénη 5 en éénη 1 gebonden cyclopentadienyl-ligand voor. Het totaal aantal elektronen dat bij de complexvorming betrokken is wordt daarmee: 6 uit de een cyclopentadiënyl, 2 elektronen uit de tweede cyclopentadiënyl-ligand en 2 keer 2 uit de koolmonoxideliganden. Samen 12, goed voor 6 coördinatiebindingen, wat het normale aantal is voor ijzer (vergelijk hexacyanoferraat). - De reductie van (ook 18 valentie-elektronen) [Ru(
η 6-C6Me6)2]2+ (beide aromatische ringen coördinerenη 6), geeft opnieuw een verbinding met 18 valentie-elektronen: [Ru(η 6-C6Me6)(η 4-C6Me6)] (zie voorbeeld).
- In het complex met 18-valentie-elektronen (
- In de heterocyclische chemie vinden we Cr(
η 5-C4H4S)(CO)3 als voorbeeld van een complex van de zwavelhoudende heterocyclische verbinding thiofeen, Cr(η 6-B3N3Me6)(CO)3 is een voorbeeld uit de anorganische chemie met een coördinerende borazinering: ( (B-CH)3(NCH3)3 ).
Door "π - liganden" gebruikte elektronen vs. hapticiteit
bewerken
| Ligand | Elektron bijdrage (neutraal deeltje) |
Elektron bijdrage (ionvorm) |
|---|---|---|
| 1 | 2 | |
cyclopropenyl |
3 | 4 |
| 3 | 4 | |
| 2 | 2 | |
| 4 | 4 | |
| 1 | 2 | |
| 3 | 4 | |
pentadienyl cyclohexadienyl |
5 | 6 |
| 2 | 2 | |
| 4 | 4 | |
| 6 | 6 | |
| 7 | 6 | |
| 8 | 10 |
Veranderingen in Hapticiteit
bewerkenDe hapticiteit van een ligand kan tijdens het verloop van een reactie veranderen[6] zoals in onderstaande redoxreactie waarbij een van de
Ook tijdens een substitutiereactie kan de hapticiteit reversibele wijzigingen ondergaan. In onderstaande reactie verandert de
Hapticiteit en Denticiteit
bewerkenHapticiteit en denticiteit zijn verwante, maar ook duidelijk verschillende begrippen. Voor polydentaat liganden geldt dat ze via meerdere punten in het molecuul bindingen naar het metaal kunnen vormen. In dat geval worden de verschillende coördinerende atomen met behulp van de
Zie ook: Hapticiteit en Moleculaire Orbitalen.
Hapticiteit en fluxionaliteit
bewerkenMoleculen waarin polyhaptoliganden voorkomen vertonen vaak ook fluxionaliteit, dat wil zeggen dat de moleculen stereochemisch niet star zijn. Twee typen fluxionaliteit komen regelmatig voor in organometaalcomplexen met polyhaptoliganden:
- In het eerste geval is de hapticiteit kleiner dan het aantal sp2 koolstofatomen. In dat soort gevallen verschuift het metaalatoom van het ene koolstofatoom naar het andere waarbij dezelfde netto hapticiteit gehandhaafd wordt. De
η 1-C5H5 ligand in (η 5-C5H5)Fe(η 1-C5H5)(CO)2 laat een snelle omlegging zien waarbij het ijzeratoom snel wisselt tussen de verschillende koolstofatomen in deη 1-C5H5 ligand. Energetisch is de reactie gedegenereerd, in de terminologie van de organische reacties wordt gesproken van een sigmatrope omlegging. - In het tweede geval is sprake van een cyclische, polyhaptische ligand waarbij de hapticiteit maximaal benut wordt. Deze liganden hebben de neiging te roteren. Een beroemd voorbeeld hiervan is ferroceen, Fe(
η 5-C5H5)2, waarin de cyclopentadienylringen roteren om de hoofdas van het molecuul. Hoewel het langs elkaar draaien van de cyclopentadienylringen geen vrije rotatie is, is de activeringsenergie zo laag, dat de verschillende rotameren niet van elkaar gescheiden kunnen worden. In ferroceen zelf is dat logisch, na een vijfde rotatie ontstaat hetzelfde molecuul, maar ook voor Fe(η 5-C5H4Br)2 is het niet mogelijk stoffen met verschillende sterische relaties tussen de broomatomen te isoleren.
Hapticiteit en Moleculaire Orbitalen
bewerkenHet optreden van coördinatiebindingen laat zich goed verklaren met behulp van de kwantummechanica. Zowel voor "gewone" complexen als voor complexen die blijkbaar in staat zijn één metaalatoom aan soms wel 8 koolstofatomen te koppelen. De kwantummechanische benadering verloopt in twee stappen. Eerst worden de koolstoforbitalen van de ligand met elkaar gecombineerd tot moleculaire orbitalen. De laagst energetische banen worden met elektronen bezet. Vervolgens worden de moleculaire orbitalen gecombineerd met de orbitalen van het metaal die dezelfde symmetrie hebben. Zo kan benzeen, met drie gevulde moleculaire orbitalen, als drietandig ligand functioneren. Omdat alle koolstofatomen in benzeen bijdragen aan de moleculaire orbitalen ontstaat hiermee een hapticiteit van 6.
- ↑ J. Dunitz, L. Orgel, A. Rich (1956). The crystal structure of ferrocene. Acta Crystallographica 9: 373–5. DOI: 10.1107/S0365110X56001091.
- ↑ F. A. Cotton (1968). Proposed nomenclature for olefin-metal and other organometallic complexes. J. Am. Chem. Soc. 90 (22): 6230–6232. DOI: 10.1021/ja01024a059.
- ↑ a b
Kubas, Gregory J. (March 1988). Molecular hydrogen complexes: coordination of a
σ bond to transition metals. Accounts of Chemical Research 21 (3): 120–128. DOI: 10.1021/ar00147a005. Gearchiveerd van origineel op 21 februari 2023. - ↑ a b
Kubas, Gregory J. (2001). Metal Dihydrogen and
σ -Bond Complexes - Structure, Theory, and Reactivity, 1. Kluwer Academic/Plenum Publishers, New York. ISBN 978-0306464652. - ↑ D. Sutton (1993). Organometallic diazo compounds. Chem. Rev. 93 (3): 995–1022. DOI: 10.1021/cr00019a008.
- ↑ Huttner, Gottfried, Lange, Siegfried, Fischer, Ernst O. (1971). Molecular Structure of Bis(Hexamethylbenzene)-Ruthenium(0). Angewandte Chemie, International Edition in English 10 (8): 556–557. DOI: 10.1002/anie.197105561.
- ↑ Nomenclature of Inorganic Chemistry – Recommendations 1990 (the 'Red Book'), Draft March 2004. IUPAC (2004), "IR-9.2.4.1 Coordination Compounds: Describing the Constitution of Coordination Compounds: Specifying donor atoms: General", p. 16. Gearchiveerd op 7 oktober 2008.