Hydroksylaza tryptofanowa
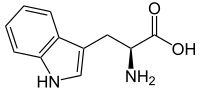
Hydroksylaza tryptofanowa (EC 1.14.16.4; w skrócie TPH) – enzym z grupy hydroksylaz związany z biosyntezą serotoniny. Przeprowadza proces transformacji L-tryptofanu do 5-hydroksytryptofanu.
Funkcja
[edytuj | edytuj kod]Hydroksylaza tryptofanowa przeprowadza reakcję hydroksylacji węgla w pozycji 5 aromatycznego pierścienia benzenowego w tryptofanie, przekształcając go tym samym w 5-hydroksytryptofan. Enzym ten bierze udział w szlaku biosyntezy serotoniny. Reguluje także jej poziom. Hydroksylaza tryptofanu bierze także udział w biosyntezie melatoniny.
Struktura
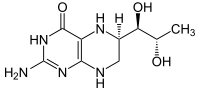
[edytuj | edytuj kod]Enzym ten jest homotetramerem, tzn. zbudowany jest z czterech identycznych podjednostek. Jego budowa jest zbliżona do dwóch podobnych funkcjonalnie enzymów, hydroksylazy fenyloalaninowej oraz hydroksylazy tyrozynowej. Na każdą z czterech podjednostek enzymu przypada jeden atom żelaza, który jest niezbędny do prawidłowej aktywności enzymatycznej.
Reakcja
[edytuj | edytuj kod]Aktywność enzymatyczna
[edytuj | edytuj kod]Hydroksylaza tryptofanowa (TPH), hydroksylaza tyrozynowa (TH) i hydroksylaza fenyloalaninowa (PAH) należą do superrodziny hydroksylaz aromatycznych aminokwasów, katalizujących kluczowe reakcje w ważnych szlakach metabolicznych. U ludzi, pobudzanie produkcji serotoniny poprzez podawanie tryptofanu ma działanie przeciwdepresyjne. Inhibicja enzymu (np. poprzez działanie p-chlorofenyloalaniny) może spowodować wystąpienie depresji.
Aktywność hydroksylazy tryptofanowej może wzrosnąć pod wpływem fosforylacji. Np. kinaza białkowa A może ufosforylować specyficzną resztę aminokwasową w enzymie, zwiększając tym samym jego aktywność.