Wikipedysta:CFCF/brudnopis/Zakażenie przewodu pokarmowego
| Gastroenteritis | |
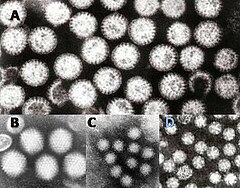 Gastroenteritis viruses: A = rotavirus, B = adenovirus, C = Norovirus and D = Astrovirus. The virus particles are shown at the same magnification to allow size comparison. | |
| Klasyfikacje | |
| DiseasesDB | |
|---|---|
| MedlinePlus | |
| MeSH | |
Zakażenie przewodu pokarmowego, gastroenteritis – choroba charakteryzująca się stanem zapalnym ("-itis") układu pokarmowego obejmującym zarówno żołądek ("gastro"-) jak i jelito cienkie ("entero"-), co prowadzi do jednoczesnego wystąpienia biegunki, wymiotów oraz bólu i skurczów jamy brzusznej[1]. Zakażenie przewodu pokarmowego nazywane jest także grypą żołądkową lub grypą jelitową, mimo że choroba nie ma nic wspólnego z grypą.
Najczęstszą przyczyną choroby u dzieci na całym świecie są rotawirusy[2]. U dorosłych chorobę wywołują najczęściej norowirusy[3] oraz bakterie z rodzaju Campylobacter[4]. Rzadziej spotykanymi przyczynami są inne bakterie (lub ich toksyny) oraz pasożyty. Zakażenie może nastąpić w wyniku spożycia nieodpowiednio przygotowanego posiłku lub skażonej wody oraz poprzez bliski kontakt z osobą zakażoną.
Podstawą leczenia jest odpowiednie nawodnienie. W przypadku łagodnego lub umiarkowanego przebiegu zazwyczaj jest to możliwe przy użyciu doustnych środków nawadniających. W przypadku poważnej choroby konieczne może być podawanie płynów dożylnie. Wirusowe zakażenie przewodu pokarmowego występuje najczęściej u dzieci oraz u mieszkańców krajów rozwijających się.
Objawy[edytuj | edytuj kod]
Zakażenie przewodu pokarmowego objawia się najczęściej biegunką i wymiotami[5], a czasami występuje tylko jeden z tych objawów[1]. Możliwe są również skurcze jamy brzusznej[1]. Objawy pojawiają się zazwyczaj od 12 do 72 godzin po kontakcie z czynnikiem zakaźnym[6]. W przypadku wirusa choroba mija po tygodniu[5]. Niektóre infekcje wirusowe mogą objawiać się gorączką, osłabieniem, bólem głowy oraz bólem mięśni[5]. W przypadku krwi w stolcu przyczyną prawdopodobnie nie jest wirus[5], lecz bakteria[7]. Niektóre zakażenia bakteryjne mogą wiązać się z ostrym bólem jamy brzusznej utrzymującym się przez kilka tygodni[7].
Dzieci zakażone rotawirusem zazwyczaj wracają do zdrowia w czasie od trzech do ośmiu dni[8]. Jednak w przypadku ubogich państw leczenie ciężkich przypadków jest często nieosiągalne, w związku z czym biegunka może utrzymywać się przez długi czas[9]. Odwodnienie jest często spotykanym powikłaniem wynikającym z biegunki[10]. Poważnie odwodnione dzieci mogą cierpieć na wydłużony powrót włośniczkowy, kiepski turgor skóry oraz zaburzenia oddechowe[11]. Do nawracającego zakażenia może dochodzić w miejscach, gdzie poziom sanitarny jest nieodpowiedni. Mogą prowadzić do niedożywienia[6], zaburzeń wzrostu oraz opóźnienia rozwoju umysłowego[12].
Reaktywne zapalenie stawów występuje u 1% osób po zakażeniu rodzajem Campylobacter, podczas gdy zespół Guillaina-Barrego występuje u 0,1%[7]. Zespół hemolityczno-mocznicowy (HUS) może również wystąpić w rezultacie wytwarzanej przez Escherichia coli lub Shigella sp. toksyny Shiga, co może skutkować małopłytkowością, niewydolnością nerek oraz anemią hemolityczną[13]. Dzieci są bardziej narażone na HUS niż osoby dorosłe[12]. Niektóre zakażenia wirusowe mogą wiązać się z łagodnymi drgawkami dziecięcymi[1].
Przyczyna[edytuj | edytuj kod]
Wirusy (zwłaszcza rotawirusy) oraz bakterie Escherichia coli i Campylobacter są najczęstszą przyczyną wirusowego zakażenia przewodu pokarmowego[14][6]. Jednak istnieje wiele innych czynników zakaźnych, które mogą być przyczyną choroby[12]. Zdarzają się również przypadki nie związane z zakażeniem, ale są one znacznie rzadsze niż przyczyny wirusowe i bakteryjne[1]. Zagrożenie zakażeniem jest znacznie wyższe u dzieci, w związku z ich brakiem odporności oraz stosunkowo niższym poziomem higieny[1].
Wirusy[edytuj | edytuj kod]
Wirusami wywołującymi zakażenie przewodu pokarmowego są rotawirusy, norowirusy, adenowirusy oraz astrowirusy[5][15]. Rotawirusy są najczęstszą przyczyną wirusowego zakażenia przewodu pokarmowego u dzieci[14], są odpowiedzialne za podobny odsetek zachorowań w krajach rozwiniętych i rozwijających się[8]. Wirusy wywołują ok. 70% przypadków wirusowej biegunki u dzieci[16]. Rotawirusy są rzadszą przyczyną choroby wśród osób dorosłych, co jest wiąże się z rozwiniętą odpornością dorosłych[17].
Norowirusy są główną przyczyną wirusowego zakażenia przewodu pokarmowego wśród dorosłych Amerykanów, wywołując 90% wybuchów epidemii[5]. Do wybuchów epidemii dochodzi zazwyczaj, gdy grupa osób spędza czas blisko siebie, np. w czasie rejsów wycieczkowych[5], w szpitalach lub w restauracjach[1]. Ludzie mogą przenosić chorobę jeszcze po ustaniu biegunki[5]. Norowirusy są przyczyną ok. 10% zachorowań dzieci[1].
Bakterie[edytuj | edytuj kod]

W krajach rozwiniętych główną przyczyną bakteryjnego zakażenia przewodu pokarmowego jest Campylobacter jejuni, z czego połowa wspomnianych przypadków związana jest z kontaktem z drobiem[7]. W przypadku dzieci bakterie są przyczyną 15% przypadków, a najczęściej spotykanymi bakteriami są Escherichia coli, Salmonella, Shigella oraz Campylobacter[16]. W przypadku skażenia żywności bakteriami oraz przechowywania jej w temperaturze pokojowej przez kilka godzin bakterie rozwijają się, a zagrożenie zakażeniem osoby spożywającej żywność wzrasta[12]. Niektóre rodzaje żywności zazwyczaj związane z chorobą to surowe lub niedogotowane mięso, drób, owoce morza oraz jajka; surowe kiełki; niepasteryzowane mleko oraz sery zwarowe; soki owocowe i warzywne[18]. W krajach rozwijających się, zwłaszcza w Afryce subsaharyjskiej oraz Azji, cholera jest często przyczyną zakażenia przewodu pokarmowego[19]. Zakażenie przenosi się zazwyczaj za pośrednictwem wody lub żywności[19].
Toksygenna Clostridium difficile jest istotną przyczyną rozwolnienia, do którego dochodzi szczególnie często u osób w podeszłym wieku[12] Niemowlęta mogą przenosić te bakterie bez rozwijania objawów[12] Jest to częstą przyczyną rozwolnienia u osób hospitalizowanych i często jest związana ze stosowaniem antybiotyków. [20]. Wywoływana przez Staphylococcus aureus biegunka zakaźna może również wystąpić u osób przyjmujących antybiotyki[21]. Biegunka podróżnych jest zazwyczaj rodzajem bakteryjnego zakażenia przewodu pokarmowego. Leki zmniejszające kwaśność soku żołądkowego wydają się zwiększać zagrożenie zakażeniem w przypadku wystawienia na działanie mikroorganizmów, włączając w to Clostridium difficile, Salmonellę oraz Campylobacter[22]. Zagrożenie jest większe w przypadku przyjmowania inhibitorów pomp protonowych niż w przypadku antagonistów receptora H2[22].
Pasożyty[edytuj | edytuj kod]
Wiele spośród pierwotniaków może być przyczyną zakażenia przewodu pokarmowego – najczęściej jest to jednak Giardia lamblia – choć może to również byćEntamoeba histolytica oraz Cryptosporidium[16]. Jako grupa wspomniane czynniki stanowią ok. 10% przyczyn choroby wśród dzieci[13]. Giardia występuje najczęściej w krajach rozwijających się, ale w pewnym stopniu jest obecna również w innych miejscach[23]. Pojawia się najczęściej u osób, które podróżują na obszarach ich występowania, dzieci przebywających w centrach opieki dziennej, mężczyzn utrzymujących stosunki seksualny z innymi mężczyznami oraz w rezultacie klęsk żywiołowych[23].
Przenoszenie[edytuj | edytuj kod]
Choroba rozprzestrzenia się za pośrednictwem zakażonej wody lub w przypadku współdzielenia przedmiotów osobistych[6]W miejscach występowania suchej i deszczowej pory roku jakość wody pogarsza się w czasie pory deszczowej, co zbiega się w czasie z wybuchami ognisk choroby[6]. W klimacie umiarkowanym zakażenia występują częściej zimą[12]. Karmione butelką dzieci na całym świecie przyjmujące pokarm z nieodpowiednio odkażanych butelek są szczególnie narażone na chorobę[6]. Odsetek przenoszenia ma również związek z nieodpowiednią higieną, zwłaszcza wśród dzieci[5], przeludnionymi lokalami mieszkalnymi[24] oraz wcześniejszym niedożywieniem[12]. Po wykształceniu odporności dorośli mogą przenosić niektóre z mikroorganizmów w sposób bezobjawowy, w związku z czym pełnią rolę rezerwuaru zarazków choroby[12] Podczas gdy niektóre z czynników (jak np. Shigella) występują tylko u naczelnych, inne mogą występować u różnych zwierząt (np.Giardia)[12].
Przyczyny niezakaźne[edytuj | edytuj kod]
Wśród przyczyn zakażenia przewodu pokarmowego znajduje się wiele przyczyn niezakaźnych[1]. Najczęściej spotykane spośród nich to leki (np. niesteroidowe leki przeciwzapalne), niektóre pokarmy jak np. laktoza (u osób nie trawiących jej) oraz gluten (u osób cierpiących na celiakię). Choroba Crohna również może być niezakaźną przyczyną zakażenia przewodu pokarmowego, często ostrego[1]. Możliwe jest również wystąpienie chorób związanych z toksynami. Niektóre z objawów związanych z pokarmami, jak np. nudności, wymioty oraz biegunkę, obejmują: zatrucie typu ciguatera związane z zakażonymi rybami drapieżnymi, scombrotoksizm związany ze spożyciem niektórych gatunków zakażonych ryb, zatrucie tetrodotoksyną w wyniku spożycia ryb rozdymkowatych oraz innych i zatrucie jadem kiełbasianym, związane zazwyczaj z nieodpowiednim przechowywaniem żywności[25].
Patofizjologia[edytuj | edytuj kod]
Zakażenie przewodu pokarmowego jest zazwyczaj definiowane jako wymioty lub biegunka wynikające z zakażenia jelita cienkiego lub grubego[12]. Zmiany występujące w jelicie cienkim nie mają zazwyczaj charakteru zapalnego, podczas gdy te występujące w jelicie grubym są zapalne[12]. Ilość patogenów, w związku z którymi dochodzi do zakażenia, może wahać się nawet od jednego (w przypadku Cryptosporidium) do 108 (w przypadku Vibrio cholerae)[12].
Diagnoza[edytuj | edytuj kod]
W warunkach klinicznych zakażenie przewodu pokarmowego jest najczęściej diagnozowane w oparciu o objawy występujące u zakażonego[5]. Określenie dokładnej przyczyny nie jest zazwyczaj konieczne, ponieważ nie ma to wpływu na przebieg leczenia[6]. Jednak w przypadku osób, u których w stolcu zauważono krew, osób narażonych na zatrucie pokarmowe oraz osób, które odwiedziły niedawno kraje rozwijające się, należy przeprowadzić badanie stolca[16]. Badania diagnostyczne mogą zostać również przeprowadzone celach kontrolnych[5]. W związku z tym, że u ok. 10% niemowląt i małych dzieci występuje hipoglikemia, sugerowana jest kontrola stężenia glukozy w surowicy krwi[11]. W przypadku zagrożenia związanego z odwodnieniem elektrolity oraz funkcja nerek również powinny zostać przebadane[16].
Odwodnienie[edytuj | edytuj kod]
Stwierdzenie, czy dana osoba jest odwodniona, stanowi ważną część badania, a odwodnienie może zostać sklasyfikowane jako łagodne (3–5%), umiarkowane (6–9%) oraz poważne (≥10%)[1]. W przypadku dzieci najpewniejszą oznaką umiarkowanego lub poważnego odwodnienia jest przedłużający się nawrót kapilarny, kiepski turgor oraz zaburzenia oddychania[11][26]. Innymi przydatnymi oznakami (w przypadku stwierdzenia kilku z nich) są podkrążone oczy, zmniejszona aktywność, brak łzawienia oraz suchość w jamie ustnej[1]. Normalna ilość moczu i płynu w jamie ustnej pozwala wykluczyć odwodnienie[11]. Badania laboratoryjne mają niewielkie znaczenie kliniczne w stwierdzaniu stopnia odwodnienia[1].
Diagnostyka różnicowa[edytuj | edytuj kod]
Inne potencjalne przyczyny objawów, które mogą wskazywać na zakażenie przewodu pokarmowego, to zapalenie wyrostka robaczkowego, skręt jelit, nieswoiste zapalenia jelit, zakażenie układu moczowego oraz cukrzyca[16]. Niewydolność trzustki, zespół krótkiego jelita, choroba Whipple'a, celiakia oraz działanie środków przeczyszczających również mogą być przyczyną objawów[27]. Diagnoza różnicowa może być skomplikowana w przypadku u osób, u których stwierdzono wyłącznie wymioty albo biegunkę [1].
Zapalenie wyrostka robaczkowego może objawiać się wymiotami, bólem brzucha oraz nieznaczną biegunką nawet w 33% przypadków[1]. Jest to znaczna różnica w stosunku do zakażenia przewodu pokarmowego, podczas którego znaczna biegunka jest jednym z typowych objawów[1]. Zakażenie płuc lub dróg moczowych u dzieci również może być przyczyną wymiotów oraz biegunki[1]. Kwasica ketonowa na tle cukrzycowym (DKA) objawia się bólem brzucha, nudnościami oraz wymiotami, ale nie biegunką[1] Badanie wykazało, że 17% dzieci, u których zdiagnozowano na początku zakażenie przewodu pokarmowego, cierpiało w rzeczywistości na DKA[1].
Profilaktyka[edytuj | edytuj kod]

Styl życia[edytuj | edytuj kod]
Łatwy dostęp do niezanieczyszczonej wody oraz odpowiednie warunki sanitarne są ważnym czynnikiem pozwalającym zmniejszyć odsetek zakażeń oraz klinicznie istotnych przypadków zakażenia przewodu pokarmowego[12]. Osobiste środki (jak np. mycie rąk) pozwalają zmniejszyć ryzyko oraz odsetek zachorowań na zakażenie przewodu pokarmowego zarówno w krajach rozwijających się, jak i rozwiniętych, nawet o 30%[11]. Skutecznym środkiem mogą być również żele na bazie alkoholu[11]. Karmienie piersią jest istotne, zwłaszcza w miejscach, gdzie higiena stoi na niskim poziomie, podobnie jak ogólna poprawa poziomu higieny[6]. Mleko z piersi zmniejsza częstotliwość zachorowań oraz skraca czas trwania choroby[1]. Unikanie zakażonej żywności oraz napojów również stanowi skuteczną metodę[28].
Szczepienia[edytuj | edytuj kod]
Z uwagi na skuteczność oraz bezpieczeństwo Światowa Organizacja Zdrowia rekomendowała w 2009 r. zapewnienie wszystkim dzieciom na świecie szczepień przeciwko rotawirusom[29][14]. Istnieją dwie dostępne komercyjnie szczepionki przeciwko rotawirusom i prowadzone są prace nad kolejnymi szczepionkami[29]. W Afryce i Azji wspomniane szczepionki pozwoliły zmniejszyć liczbę poważnych zachorowań wśród niemowląt[29], a w krajach, w których wprowadzono krajowe programy szczepień, odsetek poważnych zachorowań zmniejszył się[30][31]. Wspomniana szczepionka może również zapobiegać zachorowaniom dzieci, które nie były szczepione, ponieważ pozwala zmniejszyć ilość zakażeń w otoczeniu[32]. Począwszy od 2000 r. wprowadzenie programu szczepień przeciwko rotawirusom w USA pozwoliło zmniejszyć liczbę osób cierpiących na biegunkę o 80%[33][34][35]. Pierwsza dawka szczepionki powinna być podawana dzieciom w wieku od 6 do 15 tygodni[14]. Doustna szczepionka przeciwko cholerze zachowuje skuteczność rzędu 50–60% w okresie 2 lat[36].
Leczenie[edytuj | edytuj kod]
Zakażenie przewodu pokarmowego jest zazwyczaj ostrą, samoograniczającą się chorobą, która nie wymaga podawania leków[10]. Preferowane leczenie w przypadku łagodnego lub umiarkowanego odwodnienia to nawadnienie doustne (ORT)[13]. Metoklopramid lub ondansetron mogą być jednak przydatne w przypadku niektórych dzieci[37], podczas gdy butyloskopolamina może być przydatna przy leczeniu bólu brzucha[38].
Odwodnienie[edytuj | edytuj kod]
Główną formą leczenia zakażenia przewodu pokarmowego zarówno u dzieci jak i u dorosłych jest nawadnianie. Preferowaną metodą jest nawadnianie doustne, chociaż w przypadku ciężkiego odwodnienia lub osób, u których stwierdzono zaburzenia świadomości, konieczne może być dożylne leczenie[39][40]. Doustne środki lecznicze składające się z wodorowęglanów złożonych (np. środki przygotowane na bazie pszenicy lub ryżu) mogą być skuteczniejsze niż środki na bazie cukrów prostych[41]. Dzieciom w wieku poniżej 5 roku życia nie należy podawać napojów zawierających znaczne ilości cukrów prostych np. napojów słodzonych lub soków owocowych, ponieważ mogą one zaostrzać biegunkę[10]. Dopuszczalne jest podawanie zwykłej wody, gdy specjalistyczne i skuteczniejsze środki ORT są niedostępne lub nie są spożywane ze względu na smak[10]. Zgłębnik nosowo-żołądkowy może być wykorzystywany do podawania płynów w przypadku małych dzieci[16].
Dieta[edytuj | edytuj kod]
Zaleca się ciągłe karmienie piersią dzieci karmionych w ten sposób, podczas gdy dzieci otrzymujące mleko początkowe powinny otrzymywać pokarm zaraz po rehydratacji przy użyciu środków ORT[42] Zazwyczaj podawanie mleka początkowego niezawieracjącego laktozy lub o zmniejszonej zawartości laktozy nie jest konieczne[42] Dzieci powinny być karmione w oparciu o taką samą dietę podczas biegunki, z wyjątkiem pokarmów o dużej zawartości cukrów prostych[42] Dieta BRAT (banany, ryż, mus jabłkowy, tost oraz herbata) nie jest już zalecana, ponieważ nie zawiera odpowiedniej ilości składników odżywczych i nie uznano jej za korzystniejszą od normalnej diety[42]. Niektóre probiotyki zostały uznane za środek wspierający skracanie czasu choroby oraz obniżanie częstotliwości oddawania stolca[43]. Mogą być również skuteczne w zakresie profilaktyki oraz leczenia biegunki wywołanej przez antybiotyki[44]. Również korzystny wpływ mają produkty zawierające sfermentowane mleko (np. jogurt)[45]. Suplementy zawierające cynk również wydają się skuteczne w zakresie zarówno leczenia jak i profilaktyki wśród dzieci w krajach rozwijających się[46]
Środki przeciwwymiotne[edytuj | edytuj kod]
Leki przeciwwymiotne mogą być pomocne przy leczeniu wymiotów wśród dzieci. Ondansetron jest skutecznym środkiem doraźnym, ponieważ jego pojedyncza dawka zmniejsza potrzebę dożylnego podawania płynów, hospitalizacji oraz zapobiega wymiotom[47][48][49]Metoklopramid również może okazać się pomocnym środkiem[49]. Jednak stosowanie ondansetronu może wiązać się z rosnącym odsetkiem dzieci wracających do szpitala[50]. Podawany dożylnie roztwór ondansetronu może być podawany doustnie, jeżeli zostanie to uznane za stosowne[51]Dimenhydrynat, choć eliminuje wymioty, wydaje się nie być skutecznym środkiem klinicznym[1]
Antybiotyki[edytuj | edytuj kod]
Antybiotyki nie należą do leków podawanych zazwyczaj w czasie zakażenia przewodu pokarmowego, chociaż są czasem zalecane, gdy objawy są szczególnie poważne [52]. lub gdy przyczyną jest konkretna bakteria[53]. W przypadku antybiotyków, zalecany jest makrolid (jak np. azytromycyna) zamiast fluorochinolonu, co wiąże się z wysoką odpornością na wspomniany lek[7]Rzekomobłoniaste zapalenie jelita grubego, zazwyczaj związane ze stosowaniem antybiotyku może być kontrolowane poprzez odstawienie czynnika sprawczego i leczenie przy użyciu metronidazolu lub wankomycyny[54] Bakterie i pierwotniaki podatne na leczenie to m.in. Shigella[55]. Salmonella typhi,[56]. oraz Giardia[23] W przypadku osób, u których stwierdzono Giardia lub Entamoeba histolytica, zalecane jest stosowanie tynidazolu zamiast metronidazolu[57][23] Światowa organizacja zdrowia (WHO) zaleca stosowanie antybiotyków u małych dzieci, u których stwierdzono jednocześnie biegunkę z krwawieniem oraz gorączkę[1]
Czynniki przeciwbiegunkowe[edytuj | edytuj kod]
Leki przeciwbiegunkowe są obciążone zagrożeniem potencjalnych komplikacji i choć doświadczenia kliniczne wskazują na to, że są one rzadkie,[27] nie należy podawać ich osobom, u których wystąpiła krwawa biegunka lub biegunka z gorączką[58]Loperamid, lek opioidowy, jest często stosowany w celu objawowego leczenia biegunki[59]Jednak nie zaleca się stosowania loperamidu u dzieci, ponieważ może przedostać się przez niedojrzałą barierę krew-mózg i spowodować działanie toksyczne. Zasadowy salicylan bizmutawy, nierozpuszczalny trójwartościowy związek kompleksowy bizmutu oraz salicylanu, może być używany w przypadku łagodnego lub umiarkowanego przebiegu choroby,[27] ale toksyczność salicylanu może stanowić zagrożenie[1]
Epidemiologia[edytuj | edytuj kod]

no data
≤less 500
500–1000
1000–1500
1500–2000
2000–2500
2500–3000
Szablon:Multicol-break3000–3500
3500–4000
4000–4500
4500–5000
5000–6000
≥6000
Szablon:Multicol-endSzacuje się, że na świecie co roku dochodzi do 3-5 miliardów zachorowań na zakażenie przewodu pokarmowego,[60]. głównie wśród dzieci oraz mieszkańców krajów rozwijających się[6] Skutkuje to ok. 1,3 miliona zgonów wśród dzieci poniżej piątego roku życia, zgodnie ze stanem na 2008 r.,[61]. przy czym do większości z nich dochodzi w najuboższych państwach świata[12] Ponad 450 000 zgonów spowodowanych jest wystąpieniem rotowirusów u dzieci poniżej 5 roku życia[62][63]. Cholera jest przyczyną ok. 3-5 milionów zachorowań oraz ok. 100 000 zgonów rocznie. [19] W krajach rozwijających się dzieci w wieku poniżej 2 roku życia chorują często sześć lub więcej razy w ciągu roku, co jest przyczyną zakażenia przewodu pokarmowego, które należy leczyć w warunkach klinicznych[12] U osób dorosłych jest rzadsza, częściowo z powodu rozwoju odporność[5]
W 1980 r. zakażenie przewodu pokarmowego było przyczyną 4,6 milionów zgonów 1)wśród dzieci, w większości do zgonów dochodziło w krajach rozwijających się[54]. Odsetek zgonów został znacznie zmniejszony (do ok. 1,5 miliona zgonów rocznie) do 2000 r., w dużej mierze dzięki wprowadzeniu i upowszechnieniu się leczenia w oparciu o doustną rehydratację[64]. W US, zakażenia wywołujące zakażenie przewodu pokarmowego są drugim najczęstszym rodzajem zakażeń (zaraz po przeziębieniu) i są przyczyną 200-375 milionów przypadków ostrej biegunki [5][12] oraz ok. dziesięciu tysięcy zgonów rocznie,[12] z czego do 150-300 z nich dochodzi wśród dzieci w wieku poniżej piątego roku życia[1]
Historia[edytuj | edytuj kod]
Nazwy "zakażenie przewodu pokarmowego" użyto po raz pierwszy w 1825[65]. Wcześniej najczęściej określano je jako dur brzuszny lub "pęcherzycę choleryczną ", lub mniej dokładnie jako "ścisk jelit ", "przejedzenie się", "zm`iany", "kolkę", "problemy jelitowe " lub wieloma innymi archaizmami używanymi w odniesieniu do ostrej biegunki[66]
Społeczeństwo i kultura[edytuj | edytuj kod]
Zakażenie przewodu pokarmowego określa się wieloma kolokwialnymi nazwami m.in. "zemsta Montezumy", "indyjski brzuch", "la turista" oraz "sprint toaletowy "[12] Miało ono znaczenie w czasie wielu kampanii wojskowych i jest związane z angielskojęzycznym powiedzeniem "no guts no glory" (bez twardych bebechów nie ma zwycięstwa)[12]
Każdego roku zakażenie przewodu pokarmowego jest przyczyną 3,7 milionów wizyt u lekarzy w USA [1] oraz 3 milionów wizyt we Francji[67]. W USA zakażenie przewodu pokarmowego może kosztować nawet 23 miliardy dolarów rocznie [68]. a same roatawirusy kosztują 1 miliard dolarów rocznie[1]
Badania[edytuj | edytuj kod]
Prowadzone są prace mające na celu przygotowanie kilku szczepionek przeciwko zakażeniu przewodu pokarmowego. Przykładowo, szczepionek przeciwko Shigella i enterotoksynotwórczych Escherichia coli (ETEC), będących dwoma głównymi przyczynami zakażenia przewodu pokarmowego na świecie[69][70]
U zwierząt[edytuj | edytuj kod]
Zakażenie przewodu pokarmowego u kotów i psów jest często wywoływane przez te same czynniki co w przypadku człowieka. Najczęściej spotykanymi mikroorganizmami są:Campylobacter, Clostridium difficile, Clostridium perfringens, oraz Salmonella[71]. Przyczyną może być również jedna z wielu toksycznych roślin[72]. Niektóre czynniki są typowe dla wybranych gatunków. TGEV występuje u świń powodując wymioty, biegunkę oraz odwodnienie[73]. Uważa się, że świnie są na niego narażone w rezultacie kontaktu z dzikim ptactwem, ale obecnie niedostępny jest odpowiedni lek[74]. Choroba nie przenosi się na człowieka[75]
Przypisy[edytuj | edytuj kod]
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z Amandeep Singh. Pediatric Emergency Medicine Practice Acute Gastroenteritis — An Update. „Emergency Medicine Practice”. 7 (7), 2010. (ang.).
- ↑ Tate JE, Burton AH, Boschi-Pinto C, Steele AD, Duque J, Parashar UD. 2008 estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes: a systematic review and meta-analysis. „The Lancet Infectious Diseases”. 12 (2), s. 136–41, 2012. DOI: 10.1016/S1473-3099(11)70253-5. PMID: 22030330. (ang.).
- ↑ Marshall JA, Bruggink LD. The dynamics of norovirus outbreak epidemics: recent insights. „International Journal of Environmental Research and Public Health”. 8 (4), s. 1141–9, 2011. DOI: 10.3390/ijerph8041141. PMID: 21695033. (ang.).
- ↑ Man SM. The clinical importance of emerging Campylobacter species. „Nature Reviews. Gastroenterology & Hepatology”. 8 (12), s. 669–85, 2011. DOI: 10.1038/nrgastro.2011.191. PMID: 22025030. (ang.).
- ↑ a b c d e f g h i j k l m Eckardt AJ, Baumgart DC. Viral gastroenteritis in adults. „Recent Patents on Anti-infective Drug Discovery”. 6 (1), s. 54–63, 2011. PMID: 21210762. (ang.).
- ↑ a b c d e f g h i Roger Webber: Communicable disease epidemiology and control : a global perspective. Wyd. 3. Wallingford, Oxfordshire: Cabi, 2009, s. 79. ISBN 978-1-84593-504-7. (ang.).
- ↑ a b c d e E Galanis. Campylobacter and bacterial gastroenteritis.. „CMAJ : Canadian Medical Association”. 177 (6), s. 570–1, 2007-09-11. DOI: 10.1503/cmaj.070660. PMID: 17846438. (ang.).
- ↑ a b A Meloni, Locci, D, Frau, G, Masia, G, Nurchi, AM, Coppola, RC. Epidemiology and prevention of rotavirus infection: an underestimated issue?. „The journal of maternal-fetal & neonatal medicine : the official journal of the European Association of Perinatal Medicine, the Federation of Asia and Oceania Perinatal Societies, the International Society of Perinatal Obstetricians”. 24 Suppl 2, s. 48–51, 2011. DOI: 10.3109/14767058.2011.601920. PMID: 21749188. (ang.).
- ↑ Toolkit. [w:] DefeatDD [on-line]. [dostęp 3 maja 2012]. (ang.).
- ↑ a b c d Management of acute diarrhoea and vomiting due to gastoenteritis in children under 5. [w:] National Institute of Clinical Excellence [on-line]. 2009. (ang.).
- ↑ a b c d e f Tintinalli, Judith E.: Emergency Medicine: A Comprehensive Study Guide (Emergency Medicine (Tintinalli)). New York: McGraw-Hill Companies, 2010, s. 830–839. ISBN 0-07-148480-9. (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t Mandell 2010 Chp. 93
- ↑ a b c EJ Elliott. Acute gastroenteritis in children.. „BMJ (Clinical research ed.)”. 334 (7583), s. 35–40, 2007 Jan 6. DOI: 10.1136/bmj.39036.406169.80. PMID: 17204802. (ang.).
- ↑ a b c d H Szajewska, Dziechciarz, P. Gastrointestinal infections in the pediatric population.. „Current opinion in gastroenterology”. 26 (1), s. 36–44, 2010 Jan. DOI: 10.1097/MOG.0b013e328333d799. PMID: 19887936. (ang.).
- ↑ Dennehy PH. Viral gastroenteritis in children. „The Pediatric Infectious Disease Journal”. 30 (1), s. 63–4, 2011. DOI: 10.1097/INF.0b013e3182059102. PMID: 21173676. (ang.).
- ↑ a b c d e f g A Webb, Starr, M. Acute gastroenteritis in children.. „Australian family physician”. 34 (4), s. 227–31, 2005. PMID: 15861741. (ang.).
- ↑ Desselberger U, Huppertz HI. Immune responses to rotavirus infection and vaccination and associated correlates of protection. „The Journal of Infectious Diseases”. 203 (2), s. 188–95, 2011. DOI: 10.1093/infdis/jiq031. PMID: 21288818. (ang.).
- ↑ DG Nyachuba. Foodborne illness: is it on the rise?. „Nutrition Reviews”. 68 (5), s. 257-69, 2010 May. DOI: 10.1111/j.1753-4887.2010.00286.x. PMID: 20500787. (ang.).
- ↑ a b c RC Charles, Ryan, ET. Cholera in the 21st century.. „Current opinion in infectious diseases”. 24 (5), s. 472-7, 2011-10. DOI: 10.1097/QCO.0b013e32834a88af. PMID: 21799407. (ang.).
- ↑ V Moudgal, Sobel, JD. Clostridium difficile colitis: a review.. „Hospital practice (1995)”. 40 (1), s. 139-48, 2012 Feb. DOI: 10.3810/hp.2012.02.954. PMID: 22406889. (ang.).
- ↑ Z Lin, Kotler, DP; Schlievert, PM; Sordillo, EM. Staphylococcal enterocolitis: forgotten but not gone?. „Digestive diseases and sciences”. 55 (5), s. 1200-7, 2010=05. PMID: 19609675. (ang.).
- ↑ a b J Leonard, Marshall, JK, Moayyedi, P. Systematic review of the risk of enteric infection in patients taking acid suppression.. „The American journal of gastroenterology”. 102 (9), s. 2047–56; quiz 2057, 2007-09. DOI: 10.1111/j.1572-0241.2007.01275.x. PMID: 17509031. (ang.).
- ↑ a b c d AA Escobedo, Almirall, P, Robertson, LJ, Franco, RM, Hanevik, K, Mørch, K, Cimerman, S. Giardiasis: the ever-present threat of a neglected disease.. „Infectious disorders drug targets”. 10 (5), s. 329–48, 2010-10. PMID: 20701575. (ang.).
- ↑ K Grimwood, Forbes, DA. Acute and persistent diarrhea. „Pediatric clinics of North America”. 56 (6), s. 1343–61, 2009. DOI: 10.1016/j.pcl.2009.09.004. PMID: 19962025. (ang.).
- ↑ DT Lawrence, Dobmeier, SG; Bechtel, LK; Holstege, CP. Food poisoning.. „Emergency medicine clinics of North America”. 25 (2), s. 357-73; abstract ix, 2007 May. DOI: 10.1016/j.emc.2007.02.014. PMID: 17482025. (ang.).
- ↑ MJ Steiner, DeWalt, DA, Byerley, JS. Is this child dehydrated?. „JAMA : the Journal of the American Medical Association”. 291 (22), s. 2746–54, 2004 Jun 9. DOI: 10.1001/jama.291.22.2746. PMID: 15187057. (ang.).
- ↑ a b c The Oxford Textbook of Medicine. Wyd. 4th. Oxford University Press, 2003. ISBN 0-19-262922-0. (ang.).
- ↑ Viral Gastroenteritis. [w:] Center for Disease Control and Prevention [on-line]. February 2011. [dostęp 16 kwietnia 2012]. (ang.).
- ↑ a b c World Health Organization. Rotavirus vaccines: an update. „Weekly epidemiological record”. 51–52 (84), s. 533–540, December 2009. [dostęp 10 maja 2012]. (ang.).
- ↑ C Giaquinto, Dominiak-Felden G, Van Damme P, Myint TT, Maldonado YA, Spoulou V, Mast TC, Staat MA. Summary of effectiveness and impact of rotavirus vaccination with the oral pentavalent rotavirus vaccine: a systematic review of the experience in industrialized countries. „Human Vaccines”. 7, s. 734–748, 2011 July. DOI: 10.4161/hv.7.7.15511. PMID: 21734466. [dostęp 10 maja 2012]. (ang.).
- ↑ V Jiang, Jiang B, Tate J, Parashar UD, Patel MM. Performance of rotavirus vaccines in developed and developing countries. „Human Vaccines”. 6 (7), s. 532–542, July 2010. PMID: 20622508. [dostęp 10 maja 2012]. (ang.).
- ↑ MM Patel, Steele, D, Gentsch, JR, Wecker, J, Glass, RI, Parashar, UD. Real-world impact of rotavirus vaccination.. „The Pediatric Infectious Disease Journal”. 30 (1 Suppl), s. S1-5, 2011. DOI: 10.1097/INF.0b013e3181fefa1f. PMID: 21183833. (ang.).
- ↑ US Center for Disease Control and Prevention. Delayed onset and diminished magnitude of rotavirus activity—United States, November 2007 – May 2008. „Morbidity and Mortality Weekly Report”. 57 (25), s. 697–700, 2008. [dostęp 3 maja 2012]. (ang.).
- ↑ Reduction in rotavirus after vaccine introduction—United States, 2000–2009. „MMWR Morb. Mortal. Wkly. Rep.”. 58 (41), s. 1146–9, October 2009. PMID: 19847149. (ang.).
- ↑ JE Tate, Cortese, MM, Payne, DC, Curns, AT, Yen, C, Esposito, DH, Cortes, JE, Lopman, BA, Patel, MM, Gentsch, JR, Parashar, UD. Uptake, impact, and effectiveness of rotavirus vaccination in the United States: review of the first 3 years of postlicensure data.. „The Pediatric Infectious Disease Journal”. 30 (1 Suppl), s. S56-60, 2011 Jan. DOI: 10.1097/INF.0b013e3181fefdc0. PMID: 21183842. (ang.).
- ↑ D Sinclair, Abba, K, Zaman, K, Qadri, F, Graves, PM. Oral vaccines for preventing cholera.. „Cochrane database of systematic reviews (Online)”, s. CD008603, 2011 Mar 16. DOI: 10.1002/14651858.CD008603.pub2. PMID: 21412922. (ang.).
- ↑ Alhashimi D, Al-Hashimi H, Fedorowicz Z. Antiemetics for reducing vomiting related to acute gastroenteritis in children and adolescents. „Cochrane Database Syst Rev”, s. CD005506, 2009. DOI: 10.1002/14651858.CD005506.pub4. PMID: 19370620. (ang.).
- ↑ Tytgat GN. Hyoscine butylbromide: a review of its use in the treatment of abdominal cramping and pain. „Drugs”. 67 (9), s. 1343–57, 2007. PMID: 17547475. (ang.).
- ↑ BestBets: Fluid Treatment of Gastroenteritis in Adults. (ang.).
- ↑ Canavan A, Arant BS. Diagnosis and management of dehydration in children. „Am Fam Physician”. 80 (7), s. 692–6, October 2009. PMID: 19817339. (ang.).
- ↑ Gregorio GV, Gonzales ML, Dans LF, Martinez EG. Polymer-based oral rehydration solution for treating acute watery diarrhoea. „Cochrane Database Syst Rev”, s. CD006519, 2009. DOI: 10.1002/14651858.CD006519.pub2. PMID: 19370638. (ang.).
- ↑ a b c d King CK, Glass R, Bresee JS, Duggan C. Managing acute gastroenteritis among children: oral rehydration, maintenance, and nutritional therapy. „MMWR Recomm Rep”. 52 (RR-16), s. 1–16, November 2003. PMID: 14627948. (ang.).
- ↑ Allen SJ, Martinez EG, Gregorio GV, Dans LF. Probiotics for treating acute infectious diarrhoea. „Cochrane Database Syst Rev”. 11 (11), s. CD003048, 2010. DOI: 10.1002/14651858.CD003048.pub3. PMID: 21069673. (ang.).
- ↑ S Hempel, Newberry, SJ; Maher, AR; Wang, Z; Miles, JN; Shanman, R; Johnsen, B; Shekelle, PG. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis.. „JAMA: the Journal of the American Medical Association”. 307 (18), s. 1959-69, 2012 9 maja. PMID: 22570464. (ang.).
- ↑ Kevin Mackway-Jones: Does yogurt decrease acute diarrhoeal symptoms in children with acute gastroenteritis?. [w:] BestBets [on-line]. June 2007. (ang.).
- ↑ AM Telmesani. Oral rehydration salts, zinc supplement and rota virus vaccine in the management of childhood acute diarrhea.. „Journal of family and community medicine”. 17 (2), s. 79–82, 2010 May. DOI: 10.4103/1319-1683.71988. PMID: 21359029. (ang.).
- ↑ DeCamp LR, Byerley JS, Doshi N, Steiner MJ. Use of antiemetic agents in acute gastroenteritis: a systematic review and meta-analysis. „Arch Pediatr Adolesc Med”. 162 (9), s. 858–65, September 2008. DOI: 10.1001/archpedi.162.9.858. PMID: 18762604. (ang.).
- ↑ Mehta S, Goldman RD. Ondansetron for acute gastroenteritis in children. „Can Fam Physician”. 52 (11), s. 1397–8, 2006. PMID: 17279195. (ang.).
- ↑ a b Z Fedorowicz, Jagannath, VA, Carter, B. Antiemetics for reducing vomiting related to acute gastroenteritis in children and adolescents.. „Cochrane database of systematic reviews (Online)”. 9 (9), s. CD005506, 2011 Sep 7. DOI: 10.1002/14651858.CD005506.pub5. PMID: 21901699. (ang.).
- ↑ Sturm JJ, Hirsh DA, Schweickert A, Massey R, Simon HK. Ondansetron use in the pediatric emergency department and effects on hospitalization and return rates: are we masking alternative diagnoses?. „Ann Emerg Med”. 55 (5), s. 415–22, May 2010. DOI: 10.1016/j.annemergmed.2009.11.011. PMID: 20031265. (ang.).
- ↑ Ondansetron. [w:] Lexi-Comp [on-line]. May 2011. (ang.).
- ↑ Traa BS, Walker CL, Munos M, Black RE. Antibiotics for the treatment of dysentery in children. „Int J Epidemiol”. 39 (Suppl 1), s. i70–4, April 2010. DOI: 10.1093/ije/dyq024. PMID: 20348130. (ang.).
- ↑ Grimwood K, Forbes DA. Acute and persistent diarrhea. „Pediatr. Clin. North Am.”. 56 (6), s. 1343–61, December 2009. DOI: 10.1016/j.pcl.2009.09.004. PMID: 19962025. (ang.).
- ↑ a b Gerald L. Mandell, John E. Bennett, Raphael Dolin: Mandell's Principles and Practices of Infection Diseases. Wyd. 6th. Churchill Livingstone, 2004. ISBN 0-443-06643-4. (ang.).
- ↑ PR Christopher, David, KV, John, SM, Sankarapandian, V. Antibiotic therapy for Shigella dysentery.. „Cochrane database of systematic reviews (Online)”, s. CD006784, 2010 Aug 4. DOI: 10.1002/14651858.CD006784.pub4. PMID: 20687081. (ang.).
- ↑ EE Effa, Lassi, ZS, Critchley, JA, Garner, P, Sinclair, D, Olliaro, PL, Bhutta, ZA. Fluoroquinolones for treating typhoid and paratyphoid fever (enteric fever).. „Cochrane database of systematic reviews (Online)”, s. CD004530, 2011 Oct 5. DOI: 10.1002/14651858.CD004530.pub4. PMID: 21975746. (ang.).
- ↑ ML Gonzales, Dans, LF, Martinez, EG. Antiamoebic drugs for treating amoebic colitis.. „Cochrane database of systematic reviews (Online)”, s. CD006085, 2009 Apr 15. DOI: 10.1002/14651858.CD006085.pub2. PMID: 19370624. (ang.).
- ↑ Harrison's Principles of Internal Medicine. Wyd. 16th. McGraw-Hill. ISBN 0-07-140235-7. (ang.).
- ↑ Mark Feldman, Lawrence S. Friedman, Marvin H. Sleisenger: Sleisenger & Fordtran's Gastrointestinal and Liver Disease. Wyd. 7th. Saunders, 2002. ISBN 0-7216-8973-6. (ang.).
- ↑ EJ Elliott. Acute gastroenteritis in children.. „BMJ (Clinical research ed.)”. 334 (7583), s. 35–40, 2007 Jan 6. DOI: 10.1136/bmj.39036.406169.80. PMID: 17204802. (ang.).
- ↑ RE Black, Cousens, S, Johnson, HL, Lawn, JE, Rudan, I, Bassani, DG, Jha, P, Campbell, H, Walker, CF, Cibulskis, R, Eisele, T, Liu, L, Mathers, C, Child Health Epidemiology Reference Group of WHO and, UNICEF. Global, regional, and national causes of child mortality in 2008: a systematic analysis.. „Lancet”. 375 (9730), s. 1969–87, 2010 Jun 5. DOI: 10.1016/S0140-6736(10)60549-1. PMID: 20466419. (ang.).
- ↑ JE Tate, Burton, AH, Boschi-Pinto, C, Steele, AD, Duque, J, Parashar, UD, WHO-coordinated Global Rotavirus Surveillance, Network. 2008 estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes: a systematic review and meta-analysis.. „The Lancet infectious diseases”. 12 (2), s. 136–41, 2012 Feb. DOI: 10.1016/S1473-3099(11)70253-5. PMID: 22030330. (ang.).
- ↑ World Health Organization. Global networks for surveillance of rotavirus gastroenteritis, 2001–2008. „Weekly Epidemiological Record”. 47 (83), s. 421–428, November 2008. [dostęp 10 maja 2012]. (ang.).
- ↑ Victora CG, Bryce J, Fontaine O, Monasch R. Reducing deaths from diarrhoea through oral rehydration therapy. „Bull. World Health Organ.”. 78 (10), s. 1246–55, 2000. PMID: 11100619. (ang.).
- ↑ Gastroenteritis. [w:] Oxford English Dictionary 2011 [on-line]. [dostęp 15 stycznia, 2012]. (ang.).
- ↑ Rudy's List of Archaic Medical Terms
- ↑ A Flahault, Hanslik, T. [Epidemiology of viral gastroenteritis in France and Europe].. „Bulletin de l'Academie nationale de medecine”. 194 (8), s. 1415–24; discussion 1424-5, 2010 Nov. PMID: 22046706. (ang.).
- ↑ edited by Neil S. Skolnik ; associate editor, Ross H. Albert: Essential infectious disease topics for primary care. Totowa, NJ: Humana Press, 2008, s. 66. ISBN 978-1-58829-520-0. (ang.).
- ↑ World Health Organization: Enterotoxigenic Escherichia coli (ETEC). [w:] Diarrhoeal Diseases [on-line]. [dostęp 3 maja 2012]. (ang.).
- ↑ World Health Organization: Shigellosis. [w:] Diarrhoeal Diseases [on-line]. [dostęp 3 maja 2012]. (ang.).
- ↑ JS Weese. Bacterial enteritis in dogs and cats: diagnosis, therapy, and zoonotic potential.. „The Veterinary clinics of North America. Small animal practice”. 41 (2), s. 287-309, 2011 Mar. DOI: 10.1016/j.cvsm.2010.12.005. PMID: 21486637. (ang.).
- ↑ Wanda Haschek, Matthew Wallig, Colin Rousseaux: Fundamentals of toxicologic pathology. Wyd. 2nd ed. London: Academic, 2009, s. 182. ISBN 978-0-12-370469-6. (ang.).
- ↑ edited by N. James MacLachlan, Dubovi, Edward J.: Fenner's veterinary virology. Wyd. 4th ed. Amsterdam: Elsevier Academic Press, 2009, s. 399. ISBN 978-0-12-375158-4. (ang.).
- ↑ Laboratory animal medicine. Wyd. 2nd ed. Amsterdam: Academic Press, 2002, s. 649. ISBN 978-0-12-263951-7. (ang.).
- ↑ Diseases of swine. Wyd. 10th ed. Chichester, West Sussex: Wiley-Blackwell, s. 504. ISBN 978-0-8138-2267-9. (ang.).
- Notes
- [edited by] Gerald L. Mandell, John E. Bennett, Raphael Dolin: Mandell, Douglas, and Bennett's principles and practice of infectious diseases. Wyd. 7th ed. Philadelphia, PA: Churchill Livingstone/Elsevier, 2010. ISBN 0-443-06839-9. (ang.).
