Patch clamp

Patch clamp é uma técnica de laboratório usada em estudos de eletrofisiologia celular que permite isolar fisicamente fragmentos de membrana plasmática de uma célula ou tecido, contendo um ou mais canais iônicos, tornando possível medir o fluxo de íons (corrente elétrica) que passa através da membrana por meio destes canais. Esta técnica é especialmente útil para estudar células como: neurônios, cardiomiócitos e fibras musculares, que apresentam uma propriedade denominada bioeletrogênese. A bioeletrogênese consiste na capacidade celular de alterar a diferença de potencial elétrico da membrana plasmática, gerando os chamados “potenciais de ação”, que se propagam ao longo da membrana, sendo esta uma das principais formas de comunicação entre as células do sistema nervoso. O nome patch clamp vem do inglês: patch — pedaço, remendo (referente ao fragmento de membrana isolado); e clamp — fixação.
História da criação
[editar | editar código-fonte]Em 1976, Erwin Neher e Bert Sakmann desenvolveram o patch clamp, permitindo o primeiro registro de corrente elétrica associada a um único canal iônico em uma membrana biológica [1]. Contudo, um dos problemas observados durante o experimento foi o ruído causado pela corrente de vazamento entre o interior celular e o banho, sendo necessário o uso de enzimas para se obter um contato mais próximo entre a pipeta e a membrana. Em 1981, este problema foi contornado, onde Erwin Neher, Bert Sakmann e colaboradores descreveram o método melhorado de “giga-selo” – um contato que permite uma vedação entre a pipeta e a célula com giga ohms de resistência, permitindo isolar eletronicamente as correntes medidas nos canais com resolução mais alta e pouco ruído [2]. O enorme poder analítico da técnica permitiu a compreensão da participação dos canais iônicos em processos fisiológicos fundamentais, sendo amplamente utilizada até os dias atuais. Em reconhecimento ao desenvolvimento da técnica, Neher e Sakmann foram laureados com o Prêmio Nobel de Fisiologia ou Medicina em 1991[3].
Fundamentos
[editar | editar código-fonte]Set-up
[editar | editar código-fonte]
Durante um ensaio de patch clamp, um tubo de vidro oco com poucos milímetros de diâmetro conhecido como micropipeta, é preenchido com uma solução eletrolítica e um eletrodo de registro conectado a um amplificador. A micropipeta é então colocada em contato com a membrana de uma célula isolada ou fragmento de tecido. Outro eletrodo é colocado em um banho ao redor da célula ou tecido, atuando como terra de referência. Um circuito elétrico pode ser formado entre o eletrodo de registro e o de referência, com a célula de interesse no meio.
A solução que preenche a pipeta e a solução de banho podem variar em suas composições a depender do experimento a ser realizado, podendo corresponder às concentrações iônicas presentes no citoplasma ou no meio extracelular. O pesquisador também pode alterar o conteúdo da solução de banho (ou, menos comumente, da solução de pipeta), adicionando fármacos ou toxinas, afim de estudar os canais iônicos sob diferentes condições.
Registros
[editar | editar código-fonte]
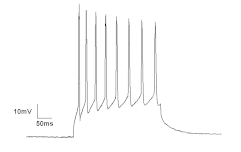

Experimentos em patch clamp podem ser realizados fixando dois diferentes parâmetros elétricos: o potencial de membrana – voltage-clamp – e a corrente elétrica – current-clamp. No caso do voltage-clamp, a tensão através da membrana celular é controlada pelo pesquisador e as correntes resultantes são registradas. O potencial elétrico no eletrodo da pipeta é registrado em relação ao eletrodo de referência colocado no banho, assim o sistema constantemente injeta uma corrente de magnitude necessária para manter o potencial da membrana constante e bem definido. A condutância dos canais pode ser calculada com base nos valores de potencial – definidos pelo pesquisador no protocolo de estímulo – e na corrente elétrica registrada. Assim é possível estudar mudanças na condutividade dos canais iônicos em resposta a variações no potencial de membrana ou em resposta a diferentes moléculas que podem modular a probabilidade de abertura e fechamento dos canais.
Em alguns casos, o pesquisador pode estar interessado em estudar alterações na diferença de potencial ao longo da membrana plasmática, associadas à condução de um sinal elétrico na forma de potenciais de ação. Assim, os experimentos podem ser realizados utilizando a técnica de current-clamp, mantendo a corrente constante enquanto observa as mudanças no potencial de membrana.
Configurações de Patch Clamp
[editar | editar código-fonte]Diversas variações da técnica básica podem ser aplicadas, dependendo do que o pesquisador deseja estudar. As técnicas inside-out e de outside-out são chamadas de técnicas de "patch excisado", porque parte da membrana é removida do restante da célula. As técnicas cell-attached e as técnicas de patch excisado são usadas para estudar o comportamento de canais iônicos individuais contidos no pedaço de membrana ligado ao eletrodo.
Os modos Whole-cell e perforated patch permitem ao pesquisador estudar o comportamento elétrico de toda a célula, registrando as macrocorrentes – somatório das correntes de todos os canais iônicos da célula – ao invés de correntes de um único canal.
Cell-attached
[editar | editar código-fonte]O termo Cell-attached em inglês significa “anexado à célula”. Como o nome diz, neste método a micropipeta é anexada à membrana celular e então é aplicada uma sucção para obter um giga-selo, garantindo que a membrana celular permaneça intacta. Isso permite o registro de correntes através de um ou alguns canais iônicos contidos no pedaço de membrana capturado pela micropipeta. Ao se ligar apenas ao exterior da membrana celular, há muita pouca perturbação na estrutura celular [4]. Além disso, por não romper o interior da célula, quaisquer mecanismos intracelulares que normalmente influenciem o canal ainda poderão funcionar como fisiologicamente [2]. Usando este método, também é relativamente fácil obter a configuração correta e, uma vez obtida, é bastante estável[5].

Para canais iônicos dependentes de ligantes ou canais que são modulados por receptores metabotrópicos, o ligante geralmente é incluído na solução da pipeta, onde pode interagir com o que costumava ser a superfície externa da membrana, já que alterações na composição fora da pipeta não afetam os canais dentro da pipeta. A atividade do canal resultante pode ser atribuída ao ligante que está sendo usado. Contudo, não é possível alterar as concentrações dentro da pipeta durante o experimento, assim, a técnica é limitada a um ponto em uma curva de dose-resposta por célula, sendo necessárias várias células para a construção de uma curva. Entretanto, os canais iônicos dependentes de voltagem podem ser testados em diferentes potenciais de membrana em uma única célula. Isso resulta na ativação do canal em função da tensão, e uma curva I-V (corrente-tensão) completa pode ser estabelecida utilizando uma única célula.
Inside-out
[editar | editar código-fonte]
No método Inside-out – lado de dentro para fora, um giga-selo é estabelecido entre a pipeta e a célula, exatamente como no Cell-attached, a pipeta é puxada, separando o pedaço de membrana do restante da célula. A remoção de um fragmento de membrana geralmente resulta inicialmente na formação de uma vesícula de membrana na ponta da pipeta, porque as extremidades da membrana se fundem rapidamente após a excisão. A face externa da vesícula deve então ser aberta para entrar no modo Inside-out; isso pode ser feito levantando a pipeta no ar e abaixando em outro banho com solução com baixo teor de Ca2+, resultando na abertura da vesícula, expondo o lado de dentro da célula para fora[2]. Uma vantagem deste método é que o pesquisador tem acesso à superfície intracelular da membrana, podendo alterar a composição química do banho que estará em contato com a superfície interna da célula. Isso é útil quando se deseja manipular o ambiente na superfície intracelular dos canais iônicos. Por exemplo, os canais que são ativados por ligantes intracelulares podem então ser estudados por meio desta técnica.
Whole-cell
[editar | editar código-fonte]
A técnica Whole-cell – do inglês: Célula inteira – envolve o registro de correntes de múltiplos canais simultaneamente, sendo assim um somatório de todas as correntes de uma célula. O giga-selo é estabelecido exatamente como no modo Cell-attached, mas neste caso, uma sucção é aplicada para romper a membrana da célula, unindo o interior da pipeta ao interior da célula. Isso fornece um meio de administrar e estudar como os tratamentos utilizando fármacos ou outros ligantes, podem afetar as células em tempo real[6]. Outro método utilizado para romper a membrana é a aplicação de um grande pulso de corrente enviado através da pipeta. A quantidade de corrente aplicada e a duração do pulso dependem do tipo de célula[5]. Para alguns tipos de células, é conveniente aplicar os dois métodos simultaneamente para romper a membrana.
A vantagem da utilização do patch clamp no modo Whole-Cell em comparação com outras técnicas que utilizam eletrodos intracelulares, é que a maior abertura na ponta do eletrodo do patch clamp fornece menor resistência e, portanto, melhor acesso elétrico ao interior da célula[7]. Uma desvantagem desta técnica é que, como o volume do eletrodo é maior que o volume da célula, graças à difusão, a composição do ambiente intracelular logo se torna idêntica à composição da solução na pipeta[5]. Depois de um tempo, quaisquer propriedades da célula que dependam do conteúdo intracelular solúvel serão alteradas. A solução de pipeta usada geralmente se aproxima do ambiente de alto teor de potássio do interior da célula para minimizar quaisquer alterações que isso possa causar. Muitas vezes há um período no início de um registro de célula inteira em que se pode fazer medições antes que o citoplasma da célula tenha sido diluído.
Perforated patch
[editar | editar código-fonte]Esta variação do método patch clamp é muito semelhante à configuração Whole-cell clássica. A principal diferença está no fato de que quando o pesquisador forma o giga-selo, a sucção não é usada para romper a membrana. Em vez disso, a solução dentro da pipeta contém pequenas quantidades de um agente antifúngico ou antibiótico, como anfotericina-B, nistatina ou gramicidina, que se difunde até a membrana formando pequenos poros nesta, fornecendo acesso elétrico ao interior da célula[8]. Ao comparar os métodos Whole-cell e Perforated patch, pode-se pensar no Whole-cell como uma porta aberta, na qual há troca completa entre as moléculas da solução de pipeta e o citoplasma. O Perforated patch pode ser comparado a uma porta de tela que permite apenas a troca de determinadas moléculas da solução da pipeta para o citoplasma da célula.

As vantagens do Perforated patch, em relação aos registros em Whole-cell, incluem as propriedades dos poros do antibiótico, que permitem o equilíbrio apenas de pequenos íons monovalentes entre a pipeta do patch e o citosol, mas não de moléculas maiores que não podem permear os poros. Essa propriedade mantém níveis endógenos de íons bivalentes como Ca2+ e moléculas sinalizadoras como o AMPc. Consequentemente, pode-se ter registros de toda a célula, mantendo a maioria dos mecanismos de sinalização intracelular, como no Cell-attached. Como resultado, há redução de corrente reduzida e gravações estáveis de patch perfurado podem durar mais de uma hora. As desvantagens incluem uma maior resistência ao acesso, em relação à célula inteira, devido à membrana parcial que ocupa a ponta do eletrodo. Isso pode diminuir a resolução atual e aumentar o ruído de gravação. Também pode levar um tempo significativo para o antibiótico perfurar a membrana (cerca de 15 minutos para anfotericina-B e ainda mais para gramicidina e nistatina). A membrana sob a ponta do eletrodo é enfraquecida pelas perfurações formadas pelo antibiótico e pode se romper [9].
Outside-out
[editar | editar código-fonte]
O nome Outside-out – de fora para fora – enfatiza o fato de colocar a superfície externa da membrana celular do lado de fora da pipeta, em contato com o banho. A formação de um Outside-out se inicia no modo Whole-cell. Depois que a configuração Whole-cell é formada, o eletrodo é retirado lentamente da célula, quando o eletrodo é puxado para longe o suficiente, pedaços de membrana se desprenderão da célula e se reformarão como uma membrana convexa na extremidade do eletrodo, com a parte externa original da membrana voltada para fora do eletrodo[2]. Como mostra a imagem à direita, isso significa que a solução dentro da pipeta estará simulando o citoplasma. Embora esta bolha de membrana possa conter mais de um canal, registros de canal único também são possíveis nesta conformação se a bolha de membrana destacada for pequena e contiver apenas um canal[10].
Este método permite examinar as propriedades de um canal iônico isolado da célula e exposto sucessivamente a diferentes soluções na superfície extracelular da membrana. O pesquisador pode perfundir o mesmo canal com uma variedade de soluções em um período de tempo relativamente curto e, se o canal for ativado por um neurotransmissor ou fármaco na face extracelular, uma curva de dose-resposta pode ser obtida[11]. Essa capacidade de medir a corrente exatamente através do mesmo pedaço de membrana em diferentes soluções é a vantagem distinta do Outside-out em relação ao modo Cell-attached. Por outro lado, este modo é mais difícil de ser alcançado. O processo de formação mais longo envolve mais etapas que podem falhar e resulta em uma frequência menor de patches viáveis.
Patch clamp automatizado
[editar | editar código-fonte]Sistemas de patch clamp automatizados foram desenvolvidos para coletar grandes quantidades de dados de forma barata em um período de tempo mais curto. Esses sistemas normalmente incluem um dispositivo microfluídico de uso único, um chip moldado por injeção ou de polidimetilsiloxano (PDMS), para capturar uma célula ou células e um eletrodo integrado.
Em tal sistema automatizado, um diferencial de pressão é usado para forçar as células em estudo a serem puxadas em direção à abertura da pipeta até formar um giga selo. Em seguida, ao expor brevemente a ponta da pipeta à atmosfera, a porção da membrana que se projeta da pipeta se rompe, e a membrana está agora na conformação de Inside-out, na ponta da pipeta. Em um sistema totalmente automatizado, a pipeta e o fragmento de membrana podem então ser movidos rapidamente através de uma série de soluções de teste diferentes, permitindo que diferentes compostos de teste sejam aplicados no lado intracelular da membrana durante o registro[12].
Aplicações
[editar | editar código-fonte]Patch-Seq
[editar | editar código-fonte]Uma combinação de imagem celular, sequenciamento de RNA e patch clamp, esse método é usado para caracterizar os neurônios em vários aspectos. Como os tecidos neurais são uma das populações de células com maior diversidade transcriptômica, classificar os neurônios em tipos de células para entender os circuitos que eles formam é um grande desafio para os neurocientistas. Combinar métodos de classificação clássicos com post-hoc de sequenciamento de RNA de célula única provou ser difícil e lento. Ao combinar várias modalidades de dados, como eletrofisiologia, sequenciamento e microscopia, o Patch-seq permite que os neurônios sejam caracterizados de várias maneiras simultaneamente[13]. Atualmente, esta técnica apresenta um baixo rendimento em relação a outros métodos de sequenciamento, principalmente em função do trabalho manual envolvido para obtenção de uma gravação de patch-clamp bem-sucedida em um neurônio. O avanço da técnica de patch clamp automatizado pode vir a minimizar essa limitação no futuro.
Referências
- ↑ Neher, Erwin; Sakmann, Bert (abril de 1976). «Single-channel currents recorded from membrane of denervated frog muscle fibres». Nature (em inglês) (5554): 799–802. ISSN 0028-0836. doi:10.1038/260799a0. Consultado em 2 de março de 2023
- ↑ a b c d Hamill, O. P.; Marty, A.; Neher, E.; Sakmann, B.; Sigworth, F. J. (agosto de 1981). «Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches». Pflügers Archiv - European Journal of Physiology (em inglês) (2): 85–100. ISSN 0031-6768. doi:10.1007/BF00656997. Consultado em 2 de março de 2023
- ↑ «THE NOBEL PRIZE IN PHYSIOLOGY OR MEDICINE 1991.». Nobelprize.org. Consultado em 2 de março de 2023
- ↑ Sakmann, B; Neher, E (outubro de 1984). «Patch Clamp Techniques for Studying Ionic Channels in Excitable Membranes». Annual Review of Physiology (em inglês) (1): 455–472. ISSN 0066-4278. doi:10.1146/annurev.ph.46.030184.002323. Consultado em 2 de março de 2023
- ↑ a b c Molleman, Areles (15 de outubro de 2002). Patch Clamping: An Introductory Guide To Patch Clamp Electrophysiology (em inglês) 1 ed. [S.l.]: Wiley
- ↑ Segev, Amir; Garcia-Oscos, Francisco; Kourrich, Saïd (15 de junho de 2016). «Whole-cell Patch-clamp Recordings in Brain Slices». Journal of Visualized Experiments (em inglês) (112). 54024 páginas. ISSN 1940-087X. PMC PMC4927800
 Verifique
Verifique |pmc=(ajuda). PMID 27341060. doi:10.3791/54024. Consultado em 2 de março de 2023 - ↑ Staley, K. J.; Otis, T. S.; Mody, I. (1 de maio de 1992). «Membrane properties of dentate gyrus granule cells: comparison of sharp microelectrode and whole-cell recordings». Journal of Neurophysiology (em inglês) (5): 1346–1358. ISSN 0022-3077. doi:10.1152/jn.1992.67.5.1346. Consultado em 2 de março de 2023
- ↑ Horn, R; Marty, A (1 de agosto de 1988). «Muscarinic activation of ionic currents measured by a new whole-cell recording method.». Journal of General Physiology (em inglês) (2): 145–159. ISSN 0022-1295. PMC PMC2228899
 Verifique
Verifique |pmc=(ajuda). PMID 2459299. doi:10.1085/jgp.92.2.145. Consultado em 2 de março de 2023 - ↑ Linley, John E. (2013). Gamper, Nikita, ed. «Perforated Whole-Cell Patch-Clamp Recording». Totowa, NJ: Humana Press: 149–157. ISBN 978-1-62703-350-3. doi:10.1007/978-1-62703-351-0_11. Consultado em 2 de março de 2023
- ↑ Howe, J R; Cull-Candy, S G; Colquhoun, D (1 de janeiro de 1991). «Currents through single glutamate receptor channels in outside-out patches from rat cerebellar granule cells.». The Journal of Physiology (em inglês) (1): 143–202. PMC PMC1181322
 Verifique
Verifique |pmc=(ajuda). PMID 1715916. doi:10.1113/jphysiol.1991.sp018381. Consultado em 2 de março de 2023 - ↑ von Beckerath, Nicolas; Adelsberger, Helmuth; Parzefall, Franz; Franke, Christian; Dudel, Josef (abril de 1995). «GABAergic inhibition of crayfish deep extensor abdominal muscle exhibits a steep dose-response relationship and a high degree of cooperativity». Pflügers Archiv (em inglês) (6): 781–788. ISSN 0031-6768. doi:10.1007/BF00374801. Consultado em 2 de março de 2023
- ↑ Vasilyev, Dmitry V.; Merrill, Thomas L.; Bowlby, Mark R. (dezembro de 2005). «Development of a Novel Automated Ion Channel Recording Method Using "Inside-Out" Whole-Cell Membranes». SLAS Discovery (em inglês) (8): 806–813. doi:10.1177/1087057105279481. Consultado em 2 de março de 2023
- ↑ Tripathy, Shreejoy J.; Toker, Lilah; Bomkamp, Claire; Mancarci, B. Ogan; Belmadani, Manuel; Pavlidis, Paul (8 de outubro de 2018). «Assessing Transcriptome Quality in Patch-Seq Datasets». Frontiers in Molecular Neuroscience. 363 páginas. ISSN 1662-5099. PMC PMC6187980
 Verifique
Verifique |pmc=(ajuda). PMID 30349457. doi:10.3389/fnmol.2018.00363. Consultado em 2 de março de 2023
