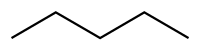
Pentano
O pentano é um hidrocarboneto com cinco carbonos e doze hidrogénios cuja fórmula química é C5 H12. Existem 3 isômeros do pentano: o n-pentano (IUPAC: pentano), o iso-pentano (IUPAC: metil butano) e o neo-pentano (IUPAC: dimetil propano). O n-pentano é um líquido incolor, inflamável e com odor similar à outros derivados do petróleo, por exemplo, a gasolina.
Cadeia Carbônica
[editar | editar código-fonte]Pelo fato deste composto possuir apenas carbonos e hidrogênios em sua estrutura, há uma baixa interação intermolecular e momento de dípolo resultante próximo a zero ou praticamente zero[1], justificando a baixíssima solubilidade em água deste composto.
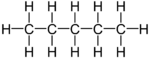

Uso
[editar | editar código-fonte]O pentano é um reagente com preço relativamente acessível e é, portanto, frequentemente utilizado como solvente apolar em laboratório. Além disso, também pode ser utilizado na produção de espumas de poliestireno[2].
Referências
[editar | editar código-fonte]- ↑ Martins, Cláudia Rocha; Lopes, Wilson Araújo; Andrade, Jailson Bittencourt de (2013). «Solubilidade das substâncias orgânicas». Química Nova (8): 1248–1255. ISSN 0100-4042. doi:10.1590/s0100-40422013000800026. Consultado em 1 de junho de 2023
- ↑ Machado, Fabricio; Lima, Enrique L.; Pinto, José Carlos (junho de 2007). «Uma revisão sobre os processos de polimerização em suspensão». Polímeros (2): 166–179. ISSN 0104-1428. doi:10.1590/s0104-14282007000200016. Consultado em 1 de junho de 2023
| Alcanos | |||||||||||||||||||||||||||||||
|
metano |
| |
etano |
| |
propano |
| |
butano |
| |
pentano |
| |
hexano |
|||||||||||||||||||||
|
heptano |
| |
octano |
| |
nonano |
| |
decano |
| |
undecano |
| |
dodecano |
| ||||||||||||||||||||