Острый респираторный дистресс-синдром
| Острый респираторный дистресс-синдром | |
|---|---|
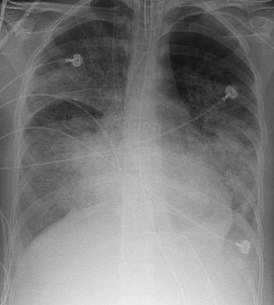 Рентгенограмма органов грудной клетки пациента с ОРДС | |
| МКБ-11 | CB00 |
| МКБ-10 | J80 |
| МКБ-10-КМ | J80 |
| МКБ-9 | 518.5, 518.82 |
| DiseasesDB | 892 |
| MedlinePlus | 000103 |
| eMedicine | med/70 |
| MeSH | D012128 |
О́стрый респирато́рный дистре́сс-синдро́м (ОРДС), также респираторный дистресс-синдром взрослых (РДСВ) — тип дыхательной недостаточности, характеризующийся быстрым началом широкого воспалительного процесса в лёгких. Симптомы включают одышку, учащённое дыхание и синеватую окраску кожи[1]. Для тех, кто выживает, снижение качества жизни является распространённым явлением[2].
История и определение
[править | править код]Впервые клинические проявления ОРДС были описаны в 1967 году у 12 пациентов, семь из которых погибли[3]. Тогда был применён термин «респираторный дистресс-синдром взрослых». В дальнейшем это состояние получало множество других названий — «некардиогенный отёк лёгких», «мокрое лёгкое», «тяжёлое лёгкое», «шоковое лёгкое»[4][5].
В 1994 году на Американо-Европейской согласительной конференции (АЕСК) было предложено новое название заболевания — ОРДС[6]. Согласно АЕСК ОРДС — острое состояние, характеризующееся двусторонней инфильтрацией лёгких и тяжёлой гипоксемией при отсутствии признаков кардиогенного отёка лёгких.
Эпидемиология
[править | править код]В США наблюдается около 190 000 случаев ОРДС в год. Ранее смертность от ОРДС была высока. С улучшением лечения в последние годы она снизилась до примерно 35—40 %[7]. Примерно 10 % всех пациентов отделений интенсивной терапии страдают от острой дыхательной недостаточности, 20 % среди них подходят под критерии ОПЛ или ОРДС[8].
Этиология
[править | править код]ОРДС возникает в результате прямого или непрямого повреждения лёгких. Непрямое повреждение лёгких возникает в результате системной воспалительной реакции при внелёгочных заболеваниях. К наиболее частым причинам относят сепсис и/или пневмонию (в том числе аспирационную), тяжёлые травмы. Другие причины представлены в таблице[9].
| Прямое повреждение лёгких | Непрямое повреждение лёгких |
|---|---|
| Аспирация | Сепсис |
| Пневмония | Тяжёлая травма |
| Диффузное альвеолярное кровотечение | Пересадка костного мозга |
| Жировая эмболия | Ожоги |
| Пересадка лёгких | Кардиопульмональный шунт |
| Утопление | Передозировка лекарств (аспирин, кокаин, опиоиды, фенотиазины, трициклические антидепрессанты) |
| Ушиб лёгкого | Массивное переливание крови |
| Вдыхание токсичного газа | Неврогенный отёк лёгких в результате инсульта, судорог, травмы головы |
| Панкреатит | |
| Рентгеноконтрастные препараты (редко) |
Патогенез
[править | править код]
В основе ОРДС лежит диффузное воспаление лёгких. В этом процессе выделяют 3 фазы: экссудативная, пролиферативная и фибротическая[8].
В экссудативную фазу в ответ на воспаление выделяются цитокины и другие провоспалительные вещества, которые активируют альвеолярные макрофаги и циркулирующие нейтрофилы. В свою очередь, активированные нейтрофилы прикрепляются к эндотелию лёгочных капилляров и высвобождают содержимое своих цитоплазматических гранул (протеазы и токсические метаболиты кислорода)[10]. Это приводит к повреждению эндотелия капилляров и эпителия альвеол, нарушая альвеолярно-капиллярный барьер. В результате экссудат проникает в лёгочную паренхиму и альвеолярное воздушное пространство. Нарушается газообмен и возникает гипоксия[11]. Также возможно повреждение альвеолоцитов II типа, которые отвечают за образование сурфактанта. При этом происходит спадение альвеол, снижение растяжимости лёгких и внутрилёгочное шунтирование. Кроме того, развивается лёгочная гипертензия в результате внутрисосудистой обструкции тромбами, спазма лёгочных сосудов из-за гипоксии и действия некоторых воспалительных медиаторов (тромбоксан, лейкотриены и эндотелин)[12].
В пролиферативную фазу у большинства пациентов происходит восстановление лёгких: удаляется экссудат, нейтрофильная инфильтрация сменяется лимфоцитарной. Пролиферируют альвеолоциты II типа, которые образуют новый сурфактант и дифференцируются в альвеолоциты I типа. Но несмотря на такие улучшения, у многих больных сохраняется одышка, тахипноэ, гипоксемия[8]. У некоторых пациентов процесс переходит в фибротическую фазу. Накопленный в лёгких фибрин подвергается ремоделированию и может вызывать фиброз[13].
Клиническая картина
[править | править код]ОРДС чаще возникает в первые 12—48 часов от начала основного заболевания (в некоторых случаях через 5—7 дней)[14]. Больной может жаловаться на одышку, дискомфорт в грудной клетке, сухой кашель. При его осмотре выявляют тахипноэ, тахикардию, участие вспомогательных мышц в дыхании, цианоз кожного покрова. При аускультации можно выявить двусторонние хрипы[11].
Диагностика
[править | править код]АЕСК опубликовала критерии диагностики ОРДС[6].
| Диагностические критерии ОРДС |
|---|
| Острое начало |
| Наличие предрасполагающего фактора |
| Двусторонние инфильтраты на рентгенограмме лёгких |
| PaO2/FiO2 < 200 мм рт. ст. при ОРДС и < 300 при ОПЛ |
| Нет признаков левожелудочковой недостаточности (отсутствие клинических данных или давление заклинивания лёгочной артерии[англ.] не выше 18 мм рт. ст.) |
ОПЛ (острое повреждение лёгких) — более лёгкая форма ОРДС; PaO2 — парциальное давление кислорода в артериальной крови (мм рт. ст.); FiO2[англ.] — фракционная концентрация кислорода во вдыхаемом газе (десятичной дробью, например 0,5)
Обнаруживают прогрессирующую гипоксемию (SpO2[англ.]* ниже 90 %), которая часто рефрактерна к ингаляциям кислорода[5]. При исследовании газов артериальной крови[англ.] на начальных стадиях ОРДС выявляют низкое PaO2, нормальное или низкое РаСО2 и повышение рН (алкалоз). В последующем РаСО2 нарастает и алкалоз сменяется ацидозом[11].
При рентгенографии лёгких видны двусторонние диффузные инфильтраты, иногда — плевральный выпот. Такие признаки неспецифичны и также характерны для кардиогенного отёка лёгких, что затрудняет дифференциальную диагностику[15][16]. Компьютерная томография показывает негомогенную инфильтрацию лёгких в определённых отделах (в задненижних отделах у лежачих больных)[17]. Это объясняется зависимым от силы тяжести распределением отёка лёгких и сдавлением вышележащими отёчными отделами лёгких[18].
Бронхоальвеолярный лаваж — наиболее надёжный метод диагностики ОРДС. При этом вводят гибкий фибробронхоскоп в один из поражённых сегментов лёгких. Затем промывают лёгочный сегмент изотоническим раствором и анализируют состав промывной жидкости[5]. У больных с ОРДС обнаруживают нейтрофилы, составляющие 60—80 % всех клеток промывной жидкости (в норме < 5 %)[19].
Лечение
[править | править код]Лечение в первую очередь направлено на устранение заболевания, приведшего к ОРДС. Если это невозможно (например, после массивных переливаний крови, аортокоронарного шунтирования и т. д.), то ограничиваются поддерживающей терапией[20].
Искусственная вентиляция лёгких
[править | править код]Стандартные объёмы искусственной вентиляции лёгких (ИВЛ) составляют 10—15 мл/кг. При ОРДС функционирует только непоражённая область лёгких, то есть ёмкость лёгких снижена, поэтому большие объёмы ИВЛ вызывают перерастяжение и разрыв дистальных воздушных пространств (волюмотравма)[21]. Кроме того, при ИВЛ возможна баротравма (при высоком уровне давления в дыхательных путях), ателектотравма (вследствие циклических расправлений и спадений альвеол) и биотравма (высвобождение провоспалительных цитокинов нейтрофилами в ответ на ИВЛ)[22][23]. Все эти повреждения объединяют под понятием вентилятор-ассоциированное повреждение лёгких[англ.][24].
В крупном исследовании, проведённым Клиническим обществом по ОРДС (англ. ARDS Clinical Network), было показано снижение смертности при вентиляции низкими объёмами (6 мл/кг и давление плато не выше 30 мм вод.ст.)[25]. Также такой режим ИВЛ снижает риск развития биотравмы[23]. Однако при вентиляции низкими объёмами возникает гиперкапния и дыхательный ацидоз. Поэтому говорят о допустимой гиперкапнии, что означает допущение определённой гиперкапнии для сохранения щадящего режима вентиляции лёгких[26]. Точные показатели неизвестны, но иccледования показывают, что для большинства пациентов допустимы будут уровни PaCO2 (парциальное давление углекислого газа в атериальной крови) 60—70 мм рт. ст. и артериального pH 7,2—7,25[27].
ИВЛ применяют в режиме положительного давления в конце выдоха[англ.] (ПДКВ, англ. PEEP) для улучшения оксигенации. ПДКВ предупреждает развитие ателектотравмы и позволяет снизить FiO2, тем самым предотвращая повреждение альвеол высокими концентрациями кислорода. Однако высокие значения ПДКВ могут приводить к перерастяжению альвеол и снижению сердечного выброса, поэтому рекомендуют начинать с малого уровня ПДКВ — 5 см вод.ст., при необходимости постепенно повышая до 20—24 см вод.ст. Есть также способ подбора ПДКВ на основе построения сигмоидальной кривой «давление-объём»[25].
См. также
[править | править код]Примечания
[править | править код]- ↑ Fan, E; Brodie, D; Slutsky, AS (20 February 2018). "Acute Respiratory Distress Syndrome: Advances in Diagnosis and Treatment". JAMA. 319 (7): 698—710. doi:10.1001/jama.2017.21907. PMID 29466596.
- ↑ Matthay, MA; Zemans, RL; Zimmerman, GA; Arabi, YM; Beitler, JR; Mercat, A; Herridge, M; Randolph, AG; Calfee, CS (14 March 2019). "Acute respiratory distress syndrome". Nature Reviews. Disease Primers. 5 (1): 18. doi:10.1038/s41572-019-0069-0. PMC 6709677. PMID 30872586.
- ↑ Ashbaugh D.G., Bigelow D.B., Petty T.L., Levine B.E. Acute respiratory distress in adults (англ.) // The Lancet. — Elsevier, 1967. — August (vol. 2, no. 7511). — P. 319—323. — PMID 4143721.
- ↑ Murray J.F., Matthay M.A., Luce J.M., Flick M.R. An expanded definition of the adult respiratory distress syndrome (англ.) // American Journal of Respiratory and Critical Care Medicine[англ.]. — 1988. — September (vol. 138, no. 3). — P. 720—723. — PMID 3202424.
- ↑ 1 2 3 Пол Л. Марино. Интенсивная терапия. — Москва: ГЭОТАР-Медиа, 2010. — 770 с. — ISBN 978-5-9704-1399-9.
- ↑ 1 2 Bernard G.R., Artigas A., Brigham K.L., et al. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination (англ.) // American Journal of Respiratory and Critical Care Medicine[англ.]. — 1994. — March (vol. 149, no. 3 Pt 1). — P. 818—824. — PMID 7509706.
- ↑ Rubenfeld G.D., Herridge M.S. Epidemiology and outcomes of acute lung injury (англ.) // Chest. — 2007. — February (vol. 131, no. 2). — P. 554—562. — doi:10.1378/chest.06-1976. — PMID 17296661.
- ↑ 1 2 3 Loscalzo, Joseph; Longo, Dan L.; Fauci, Anthony S.; Dennis L. Kasper; Hauser, Stephen L. Harrison's Principles of Internal Medicine, 18th Edition (англ.). — McGraw-Hill Education, 2011. — ISBN 0-07-174889-X.
- ↑ Ware L.B., Matthay M.A. The acute respiratory distress syndrome (англ.) // The New England Journal of Medicine. — 2000. — May (vol. 342, no. 18). — P. 1334—1349. — doi:10.1056/NEJM200005043421806. — PMID 10793167.
- ↑ Abraham E. Neutrophils and acute lung injury (англ.) // Critical Care Medicine[англ.]. — 2003. — April (vol. 31, no. 4 Suppl). — P. S195—9. — doi:10.1097/01.CCM.0000057843.47705.E8. — PMID 12682440. Архивировано 28 апреля 2012 года.
- ↑ 1 2 3 Porter, Robert. The Merck Manual of Diagnosis and Therapy (Merck Manual of Diagnosis & Therapy) (англ.). — Rahway, N.J., U.S.A: Merck, 2011. — ISBN 0-911910-19-0.
- ↑ Moloney E.D., Evans T.W. Pathophysiology and pharmacological treatment of pulmonary hypertension in acute respiratory distress syndrome (англ.) // Eur. Respir. J. : journal. — 2003. — April (vol. 21, no. 4). — P. 720—727. — PMID 12762363.
- ↑ Idell S. Coagulation, fibrinolysis, and fibrin deposition in acute lung injury (англ.) // Critical Care Medicine[англ.] : journal. — 2003. — April (vol. 31, no. 4 Suppl). — P. S213—20. — doi:10.1097/01.CCM.0000057846.21303.AB. — PMID 12682443. (недоступная ссылка)
- ↑ Iribarren C., Jacobs D.R., Sidney S., Gross M.D., Eisner M.D. Cigarette smoking, alcohol consumption, and risk of ARDS: a 15-year cohort study in a managed care setting (англ.) // Chest : journal. — 2000. — January (vol. 117, no. 1). — P. 163—168. — doi:10.1378/chest.117.1.163. — PMID 10631215.
- ↑ Aberle D.R., Brown K. Radiologic considerations in the adult respiratory distress syndrome (англ.) // Clinics in Chest Medicine : journal. — 1990. — December (vol. 11, no. 4). — P. 737—754. — PMID 2268999.
- ↑ Wiener-Kronish J.P., Matthay M.A. Pleural effusions associated with hydrostatic and increased permeability pulmonary edema (англ.) // Chest : journal. — 1988. — April (vol. 93, no. 4). — P. 852—858. — PMID 3349844.
- ↑ Gattinoni L., Caironi P., Pelosi P., Goodman L.R. What has computed tomography taught us about the acute respiratory distress syndrome? (англ.) // American Journal of Respiratory and Critical Care Medicine[англ.]. — 2001. — November (vol. 164, no. 9). — P. 1701—1711. — PMID 11719313.
- ↑ Goodman L.R. Congestive heart failure and adult respiratory distress syndrome. New insights using computed tomography (англ.) // Radiologic Clinics of North America : journal. — 1996. — January (vol. 34, no. 1). — P. 33—46. — PMID 8539352.
- ↑ Baughman R.P., Gunther K.L., Rashkin M.C., Keeton D.A., Pattishall E.N. Changes in the inflammatory response of the lung during acute respiratory distress syndrome: prognostic indicators (англ.) // American Journal of Respiratory and Critical Care Medicine[англ.]. — 1996. — July (vol. 154, no. 1). — P. 76—81. — PMID 8680703.
- ↑ Leaver S.K., Evans T.W. Acute respiratory distress syndrome (англ.) // The BMJ. — 2007. — August (vol. 335, no. 7616). — P. 389—394. — doi:10.1136/bmj.39293.624699.AD. — PMID 17717368. — PMC 1952500. Архивировано 29 июня 2019 года.
- ↑ Dreyfuss D., Soler P., Basset G., Saumon G. High inflation pressure pulmonary edema. Respective effects of high airway pressure, high tidal volume, and positive end-expiratory pressure (англ.) // American Journal of Respiratory and Critical Care Medicine[англ.]. — 1988. — May (vol. 137, no. 5). — P. 1159—1164. — PMID 3057957.
- ↑ Muscedere J.G., Mullen J.B., Gan K., Slutsky A.S. Tidal ventilation at low airway pressures can augment lung injury (англ.) // American Journal of Respiratory and Critical Care Medicine[англ.]. — 1994. — May (vol. 149, no. 5). — P. 1327—1334. — PMID 8173774.
- ↑ 1 2 Ranieri V.M., Suter P.M., Tortorella C., et al. Effect of mechanical ventilation on inflammatory mediators in patients with acute respiratory distress syndrome: a randomized controlled trial (англ.) // JAMA. — 1999. — July (vol. 282, no. 1). — P. 54—61. — PMID 10404912.
- ↑ Dreyfuss D., Saumon G. Ventilator-induced lung injury: lessons from experimental studies (англ.) // American Journal of Respiratory and Critical Care Medicine[англ.]. — 1998. — January (vol. 157, no. 1). — P. 294—323. — PMID 9445314.
- ↑ 1 2 Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network (англ.) // The New England Journal of Medicine. — 2000. — May (vol. 342, no. 18). — P. 1301—1308. — doi:10.1056/NEJM200005043421801. — PMID 10793162.
- ↑ Rogovik A., Goldman R. Permissive hypercapnia (англ.) // Emergency Medicine Clinics of North America. — 2008. — November (vol. 26, no. 4). — P. 941—952. — doi:10.1016/j.emc.2008.08.002. — PMID 19059093. Архивировано 27 марта 2020 года.
- ↑ Hickling K.G., Walsh J., Henderson S., Jackson R. Low mortality rate in adult respiratory distress syndrome using low-volume, pressure-limited ventilation with permissive hypercapnia: a prospective study (англ.) // Critical Care Medicine[англ.] : journal. — 1994. — October (vol. 22, no. 10). — P. 1568—1578. — PMID 7924367.