Eter

Etri so razred organskih spojin, ki vsebujejo etrsko skupino – kisikov atom, ki je vezan na dve (substituirani) alkilni ali arilni skupini. Splošna formula etrov je R–O–R'.[1] Značilen primer etra je topilo in anestetik dietil eter, ki mu po domače rečemo "eter" (etoksi etan, CH3-CH2-O-CH2-CH3).
Fizikalne lastnosti
[uredi | uredi kodo]Molekule etrov ne morejo tvoriti vodikovih vezi, zato imajo v primerjavi z analognimi sekundarnimi alkoholi relativno nizka vrelišča. Razlike v temperaturah vrelišča etrov in njihovih izomernih alkoholov se z naraščanjem števila ogljikovih atomov v verigi manjšajo, ker začnejo hidrofobne lastnosti ogljikove verige prevladovati nad privlaki vodikovih vezi.
Etri so rahlo polarni, ker je meri kót v strukturi C-O-C približno 110° in se dipoli C-O ne izničijo. Etri so bolj polarni kot alkeni, vendar ne toliko kot alkoholi, estri ali amidi s primerljivimi zgradbami. Prisotnost dveh prostih elektronskih parov na kisikovem atomu sicer omogoča tvorbo vodikovih vezi z vodo, vendar so topnosti alkoholov (na primer butan 1-ola) in etrov (na primer etoksietana) popolnoma različne.
Ciklični etri, na primer tetrahidrofuran in 1,4-dioksan, se popolnoma mešajo z vodo zaradi bolj izpostavljenega kisikovega atoma, ki laže tvori vodikovo vez kot alifatski etri.
Etri se lahko obnašajo kot Lewisove baze. Primer: dietil eter lahko tvori komplekse z borovimi spojinami, kot so na primer borov trifluorid dietil eterat (BF3•OEt2). Etri lahko tudi koordinirajo tudi z magnezijem v Grignardovih reagentih (RMgBr).
Nomenklatura
[uredi | uredi kodo]V IUPACovem sistemu nomenklature se za poimenovanje etrov uporablja splošna formula "alkoksialkan". Primer: eter CH3-CH2-O-CH3 se imenuje metoksietan. Če je eter del bolj kompleksne molekule, se opiše kot alkoksi- substituenta. Skupina -OCH3 je torej "metoksi" skupina. Enostavnejši alkilni radikali se zapišejo na začetku, tako da spojino CH3-O-CH2CH3 imenujemo metoksi (CH3O-) etan (-CH2CH3).
V vsakdanji rabi omenjeno spojino imenujemo preprosto "etil metil eter".
Podobne strukture
[uredi | uredi kodo]Etrov ne smemo pomešati z naslednjimi razredi spojin, ki imajo enako splošno strukturo R-O-R.
- Aromatske spojine, na primer furan (na sliki druga spojina v levi koloni), v katerem je kisikov atom del aromatskega sistema.
- Spojine, v katerih je ogljikov atom poleg kisikovega atoma vezan na kisik, dušik ali žveplo. Takšne spojine so
- Estri R-C(=O)-O-R
- Hemiacetali ali
α -hidroksi etri R-CH(-OH)-O-R - Acetali ali
α -alkoksi etri R-CH(-OR)-O-R - Hemiaminal etri ali
α -amino etri R-CH(-NR2)-O-R - Anhidridi R-C(=O)-O-C(=O)-R
Spojine, kot so
Primarni, sekundarni in terciarni etri
[uredi | uredi kodo]Termini "primarni", "sekundarni" in "tercairni eter" se uporabljajo bolj redko in se nanašajo na ogljikov atom ob kisikovem atomu v etrski skupini. V primarnem etru je ogljikov atom vezan samo na en sosednji ogljikov atom, v sekundarnem na dva in v terciarnem na tri sosednje ogljikove atome. Primer primarnega etra je dietil eter CH3-CH2-O-CH2-CH3, primer sekundarnega etra je diizopropil eter (CH3)2CH-O-CH(CH3)2, primer terciarnega etra pa di-terc-butil eter (CH3)3C-O-C(CH3)3.
Dimetil eter, primarni, sekundarni in terciarni eter.
Polietri
[uredi | uredi kodo]Polietri so spojine z več kot eno etrsko skupino. Izraz polietri se na splošno uporablja za polimere, kot sta na primer polietilen glikol in polipropilen glikol, mednje pa včasih prištejemo tudi nizkomolekularne spojine, na primer kronske etre.
Organske reakcije
[uredi | uredi kodo]Sinteze
[uredi | uredi kodo]Etre lahko v laboratoriju pripravimo na več načinov.
- Intermolekularna dehidracija alkoholov:
- R-OH + R-OH → R-O-R + H2O
- Reakcija poteče samo pod zelo ostrimi pogoji (140 °C, kisli katalizator, običajno koncentrirana žveplova kislina). Reakcija je primerna predvsem za sintezo simetričnih etrov. Uporabna je tudi za sintezo asimetričnih etrov, vendar v tem primeru dobimo zmes etrov, ki po navadi ni uporabna:
- 3R-OH + 3R'-OH → R-O-R + R'-O-R + R'-O-R' + 3H2O
- Reakcija mora biti kontrolirana. Če temperatura reakcijske zmesi preseže 170 °C, pride do intramolekularne dehidracije in tvorbe alkenov. Drugi pogoj je prebitek alkohola.
- R-CH2-CH2(OH) → R-CH=CH2 + H2O
- Tako ostri reakcijski pogoji lahko uničijo občutljive strukture, na primer funkcionalne skupine, zato za sintezo etrov uporabljamo milejše metode.
- Nukleofilna substitucija alkil halogenidov z alkoksidi:
- R-O- + R-X → R-O-R + X-
- Reakcija se imenuje Williamsonova sinteza etrov. Sinteza je sestavljena iz obdelave alkohola z močno bazo, da nastane alkoksidni anion R-O-, in reakcije z ustreznim alkil halogenidom (R-X). Za sintezo so primerni jodidi, bromidi in sulfonati. Reakcija z aromatskimi halogenidi, na primer z brom benzenom (C6H5-Br), ne poteče, poteče pa, če je med aromstskim obročem in atomom halogenega elementa vsaj en ogljikov atom, na primer s C6H5-CH2-Br. Reakcija daje dobre rezultate samo na primarnih ogljikovih atomih, ker na sekundarnih in terciarnih atomih v stiku z bazičnimi alkoksidi zaradi steričnih ovir poteče E2 eliminacija. Aril etre lahko pripravimo z Ullmannovo kondenzacijo.
- Nukleofilna substitucija alkil halogenidov s fenoksidi:
- Spojine R-X z alkoholi ne reagirajo, če alkohole zamenjamo s fenoli pa reakcija zlahka poteče. Fenoli so namreč kisli in zlahka reagirajo z močnimi bazami, na primer z NaOH, in tvorijo fenoksidne ione. Fenoksidni ion zatem zamenja skupino –X v alkil halogenidu, tako da nastane eter z arilno skupino. Reakcija poteka po SN2 mehanizmu.
- C6H5-OH + OH- → C6H5-O-
- C6H5-O- + R-X → C6H5-O-R
- Elektrofilna adicija alkoholov na alkene:
- R2C=CR2 + R-OH → R2CH-C(-O-R)-R2
- Za reakcijo je potreben kisel katalizator. Za katalizator se običajno uporablja živosrebrov trifluoroacetat (Hg(OCOCF3)2), ki tvori eter po pravilu Markovnikova. Kot zaščitne skupine za alkohole se uporabljajo tetrahidropiranil etri.
Cilkične etre, ki jih poznamo tudi kot epokside, lahko pripravimo
- Z oksidacijo alkenov s peroksi kislinami, na primer z meta-kloro-peroksibenzojevo kislino (m-CPBA).
- Z bazično intramolekularno nukleofilno substitucijo halogenhidrina.
Reakcije
[uredi | uredi kodo]Etri so na splošno zelo nereaktivni. Z etri potekajo samo naslednje kemijske reakcije:
- Hidroliza
- Etri hidrolizirajo samo pod zelo ostrimi pogoji, na primer s segrevanjem z borovim tribromidom ali s kuhanjem v bromovodikovi kislini. Nižje anorganske kisline, ki vsebujejo halogen, na primer klorovodikova kislina, etre razgradijo, vendar zelo počasi. Razgradnja etrov poteka s primerno hitrostjo samo z bromovodikovo in jodovodikovo kislino. Nekatere etre lahko razgradimo tudi z aluminijevim kloridom (AlCl3).
- Nukleofilna substitucija

- Epoksidi in ciklični etri s tričlenskimi obroči so zelo dovzetni za nukleofilne substituente.
- Tvorba peroksidov
- Primarni in sekundarni etri s CH skupino ob etrskem kisikovem atomu lahko tvorijo organske perokside, na primer dietil eter peroksid, ki so v prisotnosti kisika, svetlobe, kovin ali aldehidnih nečistoč izredno eksplozivni. V industrijskih procesih se zaradi tega uporabi etrov, na primer dietil etra ali tetrahidrofurana, po navadi izogibamo.
Nevarnosti
[uredi | uredi kodo]Eter je kemijska snov ki se zaradi svojih kemijskih lastnosti uporablja za razne pripravke in je glede na vrsto spojine uporaben za različne namene. Uporablja se npr. v medicini kot narkotično sredstvo, zaradi eksplozivnih in drugih karakteristik in lastnosti spojin pa tudi v znanstvene namene, v industriji, ipd...
Glede na vrsto snovi oz. pripravkov ga lahko najdemo v različnih agregatnih stanjih. Ravnanje s temi snovmi( pripravki ) je predpisano in strogo nadzorovano. V zvezi s temi ukrepi so snovi obvezno identificirane in opremljene z varnostnimi listi.
Varnostni list za vsako snov zahteva obvezno identifikacijo, sestavo in dobavitelja snovi, ugotavlja nevarne lastnosti, predpisuje ukrepe za ravnanje, način skladiščena, možne poškodbe, ukrepe prvo pomoč, ukrepe za preprečitev požara in postopke ter primerna, učinkovita sredstva za gašenje. Posebna pozornost je namenjena varstvu pri delu s temi snovmi, pa tudi označenost spodatki o toksičnosti, odstranjevanju, varnemu transportu. Poseben del je tudi navedek obveznega upoštevanja predpisanih ukrepov z navedbami veljavnih mednarodnih in državnih zakonov in predpisov.
Kot zanimivost na primer, Uradni list Evropske unije je objavil rezultate ocene tveganja nekaterih spojin, ena njih je tudi spojina bis(pentabromofenil) eter. Uporablja se za zaviranje gorenja v proizvodnji polimerov, polikarbonatov, termoplastičnih lepil, idr... Uporablja se tudi v električni opremi, tekstilnih materialih za zavese in oblazinjeno pohištvo.
Ocena tveganja je sledeča, za zdravje ljudi je treba opraviti podrobnejšo študijo nevrotoksičnosti. Poizkusi se opravljajo na miših in podganah. Za zdravje potrošnikov ni večjega tveganja, za prebivalstvo, izpostavljeno okolju pa prav tako zahteva podrobnejše informacije o vplivih in sicer z desetletnim biomonitoringom, ki se beleži in poroča letno.
Pomembni etri
[uredi | uredi kodo]
|
etilenoksid | Najmanjši ciklični eter. |
| dimetil eter | Potisni plin za pršila. | |
| dietil eter | Zelo hlapno topilo (Tvrerlišča = 34,6 °C), eden prvih anestetikov. | |
| dimetoksietan (DME) | Topilo (Tvrerlišča = 85 °C). | |

|
dioksan | Ciklični eter, topilo (Tvrerlišča = 101 °C). |
|
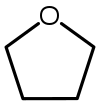
tetrahidrofuran (THF) | Ciklični eter, ki se uporablja kot polarno topilo (Tvrerlišča = 66 °C). |

|
anisol (metoksibenzene) | Cilkični eter, glavna sestavina eteričnega olja iz janeževih semen. |
|
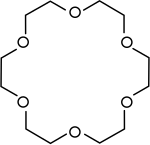
kronski eter | Cilkični etri, ki se uporabljajo kot katalizatorji faznega prenosa. |
| polietilen glikol (PEG) | Linearni polieter, ki se uporablja v kozmetičnih in farmacevtskih proizvodih. |
Reference
[uredi | uredi kodo]- ↑ International Union of Pure and Applied Chemistry. "ethers". Compendium of Chemical Terminology Internet edition.
- ↑ http://goldbook.iupac.org/A00270.html
- ↑ http://goldbook.iupac.org/H02775.html
Zunanje povezave
[uredi | uredi kodo]- Vse o etrih.
- O nenavadni medicinski tekočini, imenovani eter, M. Turner, okrog leta 1788
