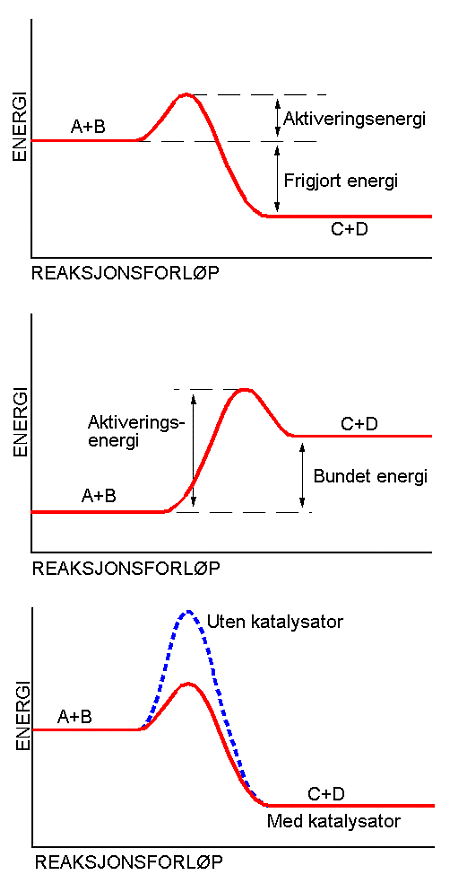
Aktiveringsenergi er den energien som utgangstoffene (reaktantene) må ha for at en kjemisk reaksjon skal kunne skje. Et eksempel på dette er når et stearinlys tennes av en fyrstikk. Da tilfører fyrstikkflammen aktiveringsenergien stearinlyset trenger for å starte å brenne.
Aktiveringsenergien er forskjellen i energi mellom utgangsstoffene og energien til overgangstilstanden, altså det mest energirike mellomstadiet under reaksjonen, øverst på energikurven i figurene.
Energien hos utgangsstoffene vil normalt være langt lavere enn aktiveringsenergien, men siden energien er ujevnt fordelt mellom molekylene (Maxwell-Boltzmanns fordelingslov), og fordi energien hele tiden utveksles mellom dem, så vil etter hvert alle utgangsmolekylene ha fått høy nok energi, og reaksjonen er fullført.
Symbolet for aktiveringsenergi er Ea. Energien måles i joule (J).




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.