Ammoniumnitrat
Ammoniumnitrat (NH4NO3) är ett salt av ammonium- och nitrat-joner.
| Ammoniumnitrat | |
 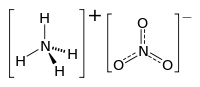 | |
| Systematiskt namn | Ammoniumnitrat |
|---|---|
| Kemisk formel | NH4NO3 |
| Molmassa | 80,043 g/mol |
| Utseende | Vita kristaller |
| CAS-nummer | 6484-52-2 |
| SMILES | [NH4+].[N+](=O)([O-])[O-] |
| Egenskaper | |
| Densitet | 1,725 g/cm³ |
| Löslighet (vatten) | 1500 g/l (20 °C) |
| Smältpunkt | 169,6 °C |
| Kokpunkt | 210 °C (sönderfaller) |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| LD50 | 2085–5300 mg/kg |
| SI-enheter & STP används om ej annat angivits | |
Egenskaper
redigeraAmmoniumnitrat är ett oxidationsmedel som bildar explosiva blandningar med brännbara material (till exempel alkoholer och oljor).
Ämnet är vattenlösligt, men hydreringen är endoterm, vilket gör att lösningen kyls ner kraftigt.
Ammoniumnitrat som upphettas till över 200 °C sönderfaller till lustgas (N2O) och vattenånga. Sönderfallet är exotermt och kan starta en kedjereaktion.
Framställning
redigeraKommersiellt tillverkad ammoniumnitrat framställs genom att leda ammoniak-gas (NH3) genom koncentrerad salpetersyra (HNO3).
Reaktionen är häftig och exoterm och kräver mycket kylning.
När lösningen har stabiliserat sig kokas överflödigt vatten bort och ammoniumnitratet formas till granulat eller pellets som sedan torkas ytterligare och förses med en skyddande hinna.
År 2022 tillverkades 48 miljoner ton ammoniumnitrat.[1]
Användning
redigeraAmmoniumnitrat blandat med dieselolja kallas ANFO och är ett billigt, stabilt och välanvänt sprängämne. Blandningen kan fås att detonera med en mekanisk chock (tryckvåg). I normala fall räcker det inte med en sprängkapsel, utan en primer bestående av exempelvis pentyl, dynamit eller annat sprängkapselkänsligt sprängämne måste användas.
På grund av den endoterma reaktionen med vatten används ammoniumnitrat bland annat i kylpåsar för engångsbruk.
Ammoniumnitrat används också som konstgödsel.
Se även
redigeraKällor
redigera- ^ Statista 2024
