டைநைட்ரசன் பெண்டாக்சைடு

| |

| |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
டை நைட்ரசன் பெண்டாக்சைடு
| |
| வேறு பெயர்கள்
நைட்ரிக் நீரிலி
நைட்ரோனியம் நைட்ரேட்டு நைட்ரைல் நைட்ரேட்டு நீரற்ற நைட்ரிக் அமிலம் | |
| இனங்காட்டிகள் | |
| 10102-03-1 | |
| ChEBI | CHEBI:29802 |
| ChemSpider | 59627 |
| EC number | 233-264-2 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 66242 |
| |
| UNII | 6XB659ZX2W |
| பண்புகள் | |
| N2O5 | |
| வாய்ப்பாட்டு எடை | 108.01 கி/மோல் |
| தோற்றம் | வெண்மையான திண்மம் |
| அடர்த்தி | 1.642 கி/செ.மீ3 (18 °செ) |
| உருகுநிலை | 41 °C (106 °F; 314 K) [1] |
| கொதிநிலை | 47 °C (117 °F; 320 K) பதங்கமாகும் |
| வினையில் ஈடுபட்டு HNO3 கிடைக்கும் | |
| கரைதிறன் | குளோரோஃபார்ம் இல் கரையும் CCl4 இல் மிகக் குறைவாக கரையும் |
| −35.6•10−6 செ.மீ3/மோல் (நீரிய) | |
| இருமுனைத் திருப்புமை (Dipole moment) | 1.39 D |
| கட்டமைப்பு | |
| படிக அமைப்பு | அறுகோணம் |
| மூலக்கூறு வடிவம் | |
| வெப்பவேதியியல் | |
| Std enthalpy of formation |
−43.1 கிலோயூல்/மோல் (தி) +11.3 கிலோயூல்/மோல் (வாயு) |
| நியம மோலார் எந்திரோப்பி S |
178.2 J கெல்வின்−1 மோல்−1 (தி) 355.6 J கெல்வின்−1 மோல்−1 (வாயு) |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | வலிமையான ஆக்சிசனேற்றி, நீருடன் சேர்ந்து வலிமையான அமிலத்தை கொடுக்கிறது. |
| தீப்பற்றும் வெப்பநிலை | தீப்பற்றாது |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
டைநைட்ரசன் பெண்டாக்சைடு (Dinitrogen pentoxide) என்பது N2O5 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். நைட்ரசன் பெண்டாக்சைடு, நைட்ரிக் நீரிலி, நைட்ரோனியம் நைட்ரேட்டு, நைட்ரைல் நைட்ரேட்டு போன்ற பல்வேறு பெயர்களால் இச்சேர்மம் அழைக்கப்படுகிறது. நைட்ரசன் மற்றும் ஆக்சிசன் மட்டுமே கொண்டுள்ள சேர்மங்களின் குடும்பத்தில் டைநைட்ரசன் பெண்டாக்சைடும் இரும நைட்ரசன் ஆக்சைடுகளில் ஓர் உறுப்பினர் ஆகும். நிலைப்புத்தன்மை அற்றதாகவும் ஓர் ஆபத்தான ஆக்சிசனேற்றியாகவும் இச்சேர்மம் கருதப்படுகிறது. ஒருகாலத்தில் இச்சேர்மம் குளோரோபார்மில் கரைக்கப்பட்டு ஒரு வினையாக்கியாக நைட்ரோயேற்ற வினைகளில் பயன்படுத்தப்பட்டு வந்த்து. ஆனால் தற்போது நைட்ரோனியம் டெட்ராபுளோரோபோரேட்டு (NO2BF4). இதற்கு மாற்றாக பயன்படுத்தப்படுவதால் டைநைட்ரசன் பெண்டாக்சைடின் பயன்பாடு வழக்கொழிந்து விட்டது.
நிபந்தனைகளைப் பொறுத்து இரண்டு கட்டமைப்புகளை ஏற்றுக்கொள்ளும் ஒரு சேர்மத்திற்கு N2O5 ஓர் அரிய எடுத்துக்காட்டாகும். : பொதுவாக இது ஓர் உப்பு, ஆனால் சில நிபந்தனைகளின் கீழ் இது ஒரு முனைவு மூலக்கூறாகும்.
தயாரிப்பு
[தொகு]டைநைட்ரசன் பெண்டாக்சைடு முதன்முதலில் 1840 ஆம் ஆண்டு பிரான்சு நாட்டு வேதியியலாளர் செயிண்ட் கிளெயர் டிவில்லி என்பவரால் தயாரிக்கப்பட்டது. வெள்ளி நைட்ரேட்டுடன் (AgNO3) குளோரினைச் சேர்த்து சூடுபடுத்தி இவர் தயாரித்தார் [2][3].
நைட்ரிக் அமிலத்துடன் பாசுபரசு பெண்டாக்சைடை சேர்த்து நீர்நீக்க வினைக்கு உட்படுத்தி டைநைட்ரசன் பெண்டாக்சைடு தயாரிக்கும் வழிமுறையே ஆய்வகங்களுக்கான தயாரிப்பு முறையாகப் பரிந்துரைக்கப்படுகிறது :[4]
- P4O10 + 12 HNO3 → 4 H3PO4 + 6 N2O5.
மாறாக இதன் தலைகீழ் செயல்பாட்டில் N2O5 தண்ணீருடன் வினைபுரிந்து (நீராற்பகுப்பு) நைட்ரிக் அமிலத்தை உருவாக்குகிறது. எனவே, டைநைட்ரசன் பெண்டாக்சைடு என்பதை நைட்ரிக் அமிலத்தின் ஒரு நீரிலியாகக் கருதலாம்.
- N2O5 + H2O → 2 HNO3
நிறமற்ற படிகங்களாக N2O5 காணப்படுகிறது. அறை வெப்பநிலைக்கு சற்று கூடுதலான வெப்பநிலையில் இது பதங்கமாகிறது. அறைவெப்பநிலையில் இறுதியாக நைட்ரசன் பெண்டாக்சைடு சிதைவடைந்து NO2 மற்றும் O2. வாயுக்களாக மாறுகிறது [5].
கட்டமைப்பு
[தொகு]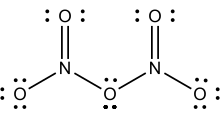
2O
5 இன் லூயிசு கட்டமைப்பு
திண்மநிலையில் காணப்படும் டைநைட்ரசன் பெண்டாக்சைடு உப்பு நேர்மின் அயனி எதிர்மின் அயனி என தனித்தனியாக பிரிக்கப்பட்ட அயனிகளால் ஆக்கப்பட்டுள்ளது. நேர்மின் அயனி நேர்கோட்டு அமைப்பை கொண்ட நைட்ரோனியம் (NO2+) அயனியாகும். இதேபோல எதிர்மின் அயனி சமதள வடிவம் கொண்ட நைட்ரேட்டு (NO3−) அயனியாகும். எனவே இத்திண்மத்தை நைட்ரோனியம் நைட்ரேட்டு என அழைக்கலாம். இரு நைட்ரசன் மையங்களும் +5. என்ற ஆக்சிசனேற்ற நிலையில் உள்ளன. மாறாத மூலக்கூறு அமைப்பு O2N–O–NO2 வாயுநிலையில் காணப்படுகிறது. திண்ம டைநைட்ரசன் பெண்டாக்சைடை முனைவற்ற கரைப்பான் கார்பன் டெட்ராகுளோரைடுடன் சேர்த்து வினைப்படுத்தினால் பதங்கமாதல் மூலம் இவ்வாயுநிலை சேர்மம் கிடைக்கிறது. இந்நிலை சேர்மத்திலுள்ள O–N–O பிணைப்புகளுக்கிடையே உள்ள பிணைப்புக் கோணம் 133° மற்றும் N–O–N பிணைப்புகளுக்கிடையே உள்ள பிணைப்புக் கோணம் 114° ஆகும். வேகமாக குளிர்விக்கப்பட்டால் சிற்றுருதி நிலை மூலக்கூற்று வடிவம் தோன்றுகிறது. அப்போது −70 °செல்சியசு வெப்பநிலைக்கு மேலான வெப்பநிலையில் வெப்பம் உமிழ்தலுடன் அயனச் சேர்ம வடிவத்திற்கான மாற்றம் நிகழ்கிறது[4].
வினைகள் மற்றும் பயன்கள்
[தொகு]டைநைட்ரசன் பெண்டாக்சைடு எடுத்துக்காட்டாக, குளோரோஃபார்மில் ஒரு கரைசலாக இருக்கும்போது NO2 குழுவை அறிமுகப்படுத்த ஒரு வினையாக்கியாக பயன்படுத்தப்படுகிறது. இந்த நைட்ரோயேற்ற வினை பின்வருமாறு குறிப்பிடப்படுகிறது:
- N2O5 + Ar–H → HNO3 + Ar–NO2
இங்குள்ள Ar என்பது அரீன் மையத்தை குறிக்கிறது.
இப்பயனுக்காக டைநைட்ரசன் பெண்டாக்சைடு சேர்மம் நைட்ரோனியம் டெட்ராபுளோரோபோரேட்டால் [NO
2]+[BF
4]−. இடப்பெயர்ச்சி செய்யப்பட்டுள்ளது.
NO2+ இன் உயர் வினைத்திறனை இவ்வுப்பு தக்கவைத்துக் கொள்கிறது. ஆனால் இது வெப்பவியல் ரீதியாக நிலைப்புத்தன்மை கொண்டிருக்கிறது. 180 °செல்சியசு வெப்பநிலையில் நைட்ரைல் புளோரைடு (NO2F) மற்றும் போரான் டிரைபுளோரைடுகளாக சிதைவடைகிறது. (BF3). உயர் மின்னணுமிகுபொருள்களை (HNO22+) உற்பத்தி செய்யும் வலிமையான அமிலங்களை சேர்த்து NO2+ அயனியின் வினைத்திறனை மேலும் அதிகரிக்க இயலும். வெடிபொருட்கள் தயாரிப்பதற்கு டைநைட்ரசன் பெண்டாக்சைடு பொருத்தமான சேர்மமாகும்[3][6]
டைநைட்ரசன் பெண்டாக்சைடு என்பது வளிமண்டலத்தில் ஓசோன் குறைவுக்கு காரணமான NOx வேதி இனங்களின் முக்கியமான சேமிப்பிடம் ஆகும்:
இதன் உருவாக்கம் NO மற்றும் NO2 இரண்டையும் தற்காலிகமாக வினைபுரியா மந்தநிலையில் வைத்திருக்கும் வெற்றுச் சுழற்சியை வழங்குகிறது[7]. பில்லியனுக்கு பல பகுதிகள் கன அளவு கலப்பு விகித டைநைட்ரசன் பெண்டாக்சைடு இரவு நேர வெப்பமண்டலத்தின் மாசுபட்ட பகுதிகளில் காணப்படுகின்றன[8].
இதே உயரத்திலுள்ள அடுக்கு மண்டலத்திலும் டைநைட்ரசன் பெண்டாக்சைடு காணப்படுகிறது[9]. நோக்சன் செங்குத்து என அழைக்கப்படும் 50° வடக்கிற்கு மேலுள்ள அடுக்கு மண்டல NO2 அளவுகள் திடீரென வீழ்ச்சியடைவதால் இத்தகைய சேமிப்பகங்கங்கள் உருவாகின்றன என பரிந்துரைக்கப்பட்டுள்ளது.
தூசுப்படலத்தின் N2O5 வினைத்திறன் மாறுபாடுகளால் வெப்பமண்டல ஓசோன், ஐதராக்சில் இயங்குறுப்புகள், NOx இணங்களின் செறிவு போன்றவற்றில் குறிப்பிட்ததக்க இழப்பு ஏற்படுத்தலாம்[10]. வளிமண்டல தூசுப்படலத்தில் N2O5 இன் இரண்டு முக்கியமான வினைகள் கீழே கொடுக்கப்படுகின்றன. : 1)நைட்ரிக் அமிலம் உருவாதலுக்கான நீராற்பகுப்பு[11]
2)ஆலைடு அயனிகளுடன் வினை. குறிப்பாக Cl− அயனிகளுடன் வினைபுரிந்து ClNO2 மூலக்கூறுகள் உருவாக்கம். விண்வெளியில் வினைத்திற குளோரின் அணுக்கள் உருவாக்கத்திற்கான முன்னோடிச் சேர்மமாக இது பயன்படுகிறது[12][13].
தீங்குகள்
[தொகு]N2O5 என்பது ஒரு வலுவான ஆக்சிசனேற்றியாகும். கரிம சேர்மங்கள் மற்றும் அம்மோனியம் உப்புகளுடன் இணைந்து வெடிக்கும் சேர்மங்களை இது உருவாக்குகிறது. டைநைட்ரசன் பெண்டாக்சைடின் சிதைவு மிகவும் நச்சுத்தன்மையுள்ள நைட்ரசன் டை ஆக்சைடு வாயுவை உருவாக்குகிறது.
மேற்கோள்கள்
[தொகு]- ↑ Emeleus (1 January 1964). Advances in Inorganic Chemistry. Academic Press. pp. 77–. பன்னாட்டுத் தரப்புத்தக எண் 978-0-12-023606-0. பார்க்கப்பட்ட நாள் 20 September 2011.
- ↑ M.H. Deville (1849). "Note sur la production de l'acide nitrique anhydre". Compt. Rend. 28: 257–260. https://archive.org/details/comptesrendusheb28acad.
- ↑ 3.0 3.1 Jai Prakash Agrawal (19 April 2010). High Energy Materials: Propellants, Explosives and Pyrotechnics. Wiley-VCH. pp. 117–. பன்னாட்டுத் தரப்புத்தக எண் 978-3-527-32610-5. பார்க்கப்பட்ட நாள் 20 September 2011.
- ↑ 4.0 4.1 Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, பன்னாட்டுத் தரப்புத்தக எண் 0-12-352651-5
- ↑ Nitrogen(V) Oxide. Inorganic Syntheses. Vol. 3. 1950. pp. 78–81.
- ↑ Talawar, M. B. (2005). "Establishment of Process Technology for the Manufacture of Dinitrogen Pentoxide and its Utility for the Synthesis of Most Powerful Explosive of Today—CL-20". Journal of Hazardous Materials 124 (1–3): 153–64. doi:10.1016/j.jhazmat.2005.04.021. பப்மெட்:15979786.
- ↑ Finlayson-Pitts, Barbara J.; Pitts, James N. (2000). Chemistry of the upper and lower atmosphere : theory, experiments, and applications. San Diego: Academic Press. பன்னாட்டுத் தரப்புத்தக எண் 9780080529073. இணையக் கணினி நூலக மைய எண் 162128929.
- ↑ HaiChao Wang (2017). "High N2O5 Concentrations Observed in Urban Beijing: Implications of a Large Nitrate Formation Pathway". Environmental Science and Technology Letters 4 (10): 416–420. doi:10.1021/acs.estlett.7b00341.
- ↑ C.P. Rinsland (1989). "Stratospheric N205 profiles at sunrise and sunset from further analysis of the ATMOS/Spacelab 3 solar spectra". Journal of Geophysical Research 94: 18341–18349. doi:10.1029/JD094iD15p18341. Bibcode: 1989JGR....9418341R.
- ↑ Macintyre, H. L.; Evans, M. J. (2010-08-09). "Sensitivity of a global model to the uptake of N2O5 by tropospheric aerosol". Atmospheric Chemistry and Physics 10 (15): 7409–7414. doi:10.5194/acp-10-7409-2010. பன்னாட்டுத் தர தொடர் எண்:1680-7324.
- ↑ Brown, S. S.; Dibb, J. E.; Stark, H.; Aldener, M.; Vozella, M.; Whitlow, S.; Williams, E. J.; Lerner, B. M. et al. (2004-04-16). "Nighttime removal of NOx in the summer marine boundary layer" (in en). Geophysical Research Letters 31 (7): n/a. doi:10.1029/2004GL019412. பன்னாட்டுத் தர தொடர் எண்:1944-8007.
- ↑ Gerber, R. Benny; Finlayson-Pitts, Barbara J.; Hammerich, Audrey Dell (2015-07-15). "Mechanism for formation of atmospheric Cl atom precursors in the reaction of dinitrogen oxides with HCl/Cl− on aqueous films" (in en). Physical Chemistry Chemical Physics 17 (29): 19360–19370. doi:10.1039/C5CP02664D. பன்னாட்டுத் தர தொடர் எண்:1463-9084. பப்மெட்:26140681. Bibcode: 2015PCCP...1719360H. https://escholarship.org/content/qt3087m4xv/qt3087m4xv.pdf?t=oubfuu.
- ↑ Kelleher, Patrick J.; Menges, Fabian S.; DePalma, Joseph W.; Denton, Joanna K.; Johnson, Mark A.; Weddle, Gary H.; Hirshberg, Barak; Gerber, R. Benny (2017-09-18). "Trapping and Structural Characterization of the XNO2•NO3– (X = Cl, Br, I) Exit Channel Complexes in the Water-Mediated X– + N2O5 Reactions with Cryogenic Vibrational Spectroscopy". The Journal of Physical Chemistry Letters 8 (19): 4710–4715. doi:10.1021/acs.jpclett.7b02120. பன்னாட்டுத் தர தொடர் எண்:1948-7185. பப்மெட்:28898581.
