రసాయన సమీకరణాలు

రసాయన సమీకరణం అనునది రసాయన చర్యను సంకేతాల రూపంలో చూపించే విధానం. ఇందులో సంకేతాలు, ఫార్ములాలు ఉపయోగించి వ్రాస్తారు. ఒక రసాయన చర్యలో చర్యలో పాల్గొనిన పదార్థాలను "క్రియా జనకాలు" అంటారు. చర్య జరిగిన తదుపరి ఏర్పడిన పదార్థాలను "క్రియా జన్యాలు" అంటారు. రసాయన సమీకరణంలో క్రియా జనకాలను ఎడమవైపు, క్రియాజన్యాలను కుడివైపు వ్రాసారు. [1] రసాయన సమీకరణంలో పదార్థాలను సంకేతాల రూపంలో లేదా ఫార్ములాల రూపంలో రాస్తారు. వాటి ముండు అవి పాల్గొన్న అణువుల సంఖ్యలను చేర్చుతారు. మొట్టమొదటి రసాయన సమీకరణాన్ని జీన్ బెగూన్ 1615లో ఉపయోగించాడు.[2]
రసాయన సమీకరణం ఏర్పడుట
[మార్చు]రసాయన సమీకరణంలో క్రియాజనకాల, క్రియాజన్యాల రసాయన ఫార్ములాలు ఉంటాయి. వీటిని ఒక బాణం గుర్తుతో వేరుచేస్తారు. ఈ బాణం గుర్తును () "యీల్డ్స్" లేదా గివ్స్ రైజ్ టు" అని చదువుతారు. క్రియాజనకాలు లేదా క్రియాజన్యాలు ఎక్కువగా ఉంటే వాటి మధ్య సంకలన గుర్తు (+) ను ఉంచుతారు.
ఉదాహరణకు హైడ్రోక్లోరికామ్లం (ఉదహకరికామ్లం) సోడియం లోహంతో చర్య జరిపినపుడు సమీకరణాన్ని క్రిందివిధంగా సూచిస్తారు:
- 2 HCl + 2 Na → 2 NaCl + H
2
ఈ సమీకరణాన్ని "టు HCl ప్లస్ టు Na యీల్డ్స్ టు NaCl ప్లస్ Hటు" అని చదువుతారు. సంక్లిష్ట రసాయన పదార్థాలు కలిగిన రసాయన సమీకరణాలలో అక్షరాలను చదవడం, వాటి పాదాంకాలను (sub script) చదువుతూ రసాయన సమీకరణాలను IUPAC నామీకరణ విధానంలో చదువుతారు. IUPAC నామీకరణ విధానంలో పై సమీకరణాన్ని "హైడ్రోక్లోరిక్ ఆసిడ్ ప్లస్ సోడియం యీల్డ్స్ సోడియం క్లోరైడ్ అండ్ హైడ్రోజన్ గ్యాస్" అని చదువుతారు.
ఈ సమీకరణం సోడియం, హైడ్రోక్లోరికామం చర్య చరిపి NaCl, H2 ఏర్పడతాయని తెలియజేస్తుంది. అదే విధంగా రెండు సోడియం అణువులు రెండు హైడ్రోక్లోరికామ్లపు అణువులతో చర్య జరిపి రెండు సోడియం క్లోరైడ్ అణువులను, ఒక ద్విపరమాణుక హైడ్రోజన్ వాయువును వెలువరుస్తాయని కూడా తెలియజేస్తుంది.
ఈ చర్యలో "ద్రవ్య నిత్యత్వ నియమం", "స్థిర అనుపాత నియమం" లకు అనుగుణంగా ఫార్ములాల ముందు పుర్ణాంకాలను చేర్చుతారు. ఈవిధానాన్ని సమీకరణాలను తుల్యం చేయు విధానంలో తెలుసుకోవచ్చు.
సాధారణ సంకేతాలు
[మార్చు]వివిధ రసాయన చర్యలను వేరుచేయుతకు ఈ క్రింది సంకేతాలను వాడుతారు. ఈ రసాయన చర్యల రకాన్ని గుర్తించేందుకు: [3]
- "" గుర్తు తుల్య సమీకరణాన్ని సూచించేందుకు ఉపయోగిస్తారు.
- "" ఇది పురోగామి చర్యను తెలియజేసేందుకు ఉపయోగిస్తారు.
- "" ఇది పురోగామి, తిరోగామి చర్యలను (ద్విగత చర్యలు) తెలియజేసేందుకు ఉపయోగిస్తారు.
- "" ఈ గుర్తును సమతాస్థితిలో ఉన్న చర్యలను తెలియజేసేందుకు ఉపయోగిస్తారు.
రసాయన సమీకరణంలో ప్రతీ రసాయన పదార్థం నకు పాదాంకాలుగా వాటి భౌతిక స్థితిని బ్రాకెట్లలో రాస్తారు. పదార్థం ఘన స్థితిలో ఉంటే (ఘ) అని, ద్రవ స్థితిలో ఉంటే (ద్ర) అనీ, వాయు స్థితిలో ఉంటే (వా) అనీ, జల ద్రావణ మైతే (జ.ద్రా) అని వ్రాస్తారు.
ఒకవేళ రసాయన సమీకరణం శక్తిని గ్రహిస్తే ఆ అంశాలను బాణం గుర్తుపై భాగంలో వ్రాస్తారు. రసాయన చర్యలో ఉష్ణం గ్రహించబడితే బాణం గుర్తుపై గ్రీకు అక్షరం డెల్టా () ను ఉంచుతారు. కాంతి రసాయన సమీకరణం అయితే ను బ్రాకెట్ పై ఉంచుతారు.
రసాయన సమీకరణాన్ని తుల్యం చేయుట
[మార్చు]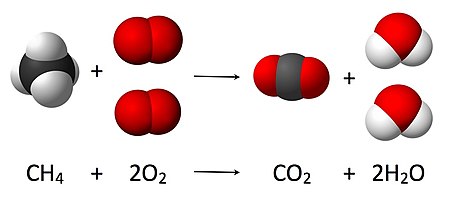
4 + 2 O
2 → CO
2 + 2 H
2O, a coefficient of 2 must be placed before the oxygen gas on the reactants side and before the water on the products side in order for, as per the law of conservation of mass, the quantity of each element does not change during the reaction

This chemical equation is being balanced by first multiplying H3PO4 by four to match the number of P atoms, and then multiplying H2O by six to match the numbers of H and O atoms.
ద్రవ్య నిత్యత్వ నియమం ప్రకారం రసాయన చర్యలో క్రియాజనకాల ద్రవ్యరాశుల మొత్తం క్రియాజన్యాల ద్రవ్యరాశుల మొత్తానికి సమానంగ ఉంటుంది. రసాయన చర్యలో ప్రతీ మూలకం క్రియాజనకాలలో, క్రియాజన్యాలలోఒకే ద్రవ్యరాశి కలిగి ఉంటుంది. రసాయన చర్యలో ఆవేశం కూడా నిత్యత్యం చెందుతుంది. అందువలన తుల్య సమీకరణంలో ఒకే ఆవేశం రెండువైపుల ఉంటుంది. ఒక రసాయన సమీకరణాన్ని తుల్యం[4] చేసినపుడు ప్రతీ రసాయన ఫార్ములాకు ముందు సంఖ్యను మార్చుతూ రెండు వైపుల పరమాణువుల సంఖ్య సమానంగా ఉండేటట్లు చూసుకోవాలి. సాధారణ సమీకరణమును యత్న దోష పద్ధతి (trial and error method) ద్వారా తుల్యం చేస్తారు. రేఖీయ సమీకరణాల ద్వారా కూడా తుల్యం చేయవచ్చు. తుల్యసమీకరణాలలోని గుణకాలు అతి చిన్న పూర్ణాంకాలలో ఉండేటట్లు చూసుకోవాలి. ఏ విధమైన గుణకం లేనిచో అది ఒకటి అవుతుంది. ఈ విధనంలో అతి సంక్లిష్ట రసాయన ఫార్ములాకు ముందు 1 గుణకంగా ఉంచి, రసాయన సమీకరణములో రెండువైపులా పరమాణువులూ ఒకే సంఖ్యలో వచ్చునట్లు యితర ఫార్ములాలు ముందు గుణకాలను చేర్చాలి. ఒకవేళ గుణకాలు భిన్నాలు వస్తే, ఆ గుణకాలను అతి చిన్న సంఖ్యతో గుణించి పూర్ణాంకాలుగా మారునట్లు చేయాలి. ఉదాహరణకు, పై చిత్రంలో మీథేన్ మండించినపుడు జరిగే రసాయన చర్య యివ్వబడింది. దీనిలో మీథేన్ CH4 గుణకంగా 1 ఉమాలి. అపుడు:
- 1 CH4 + O2 → CO2 + H2O
- ఈ రసాయన చర్యలో క్రియాజనకాలు, క్రియా జన్యాలలో కార్బన్ పరమాణువు 1 ఉన్నది. కనుక కార్బన్ పరమాణువు తుల్యం అయినది.
తరువాత హైడ్రోజన్ విషయానికొస్తే ఎడమవైపు నాలుగు పరమాణువులు, కుడివైపు రెండు పరమాణువులు ఉన్నాయి. వీటిని తుల్యం చేయడానికి క్రియాజన్యాలలో ఉన్న నీటి అణువు (H2O) ముందు గుణకంగా 2 ఉంచాలి. అపుడు సమీకరణం:
- 1 CH4 + O2 → CO2 + 2 H2O
ఇపుడు క్రియాజనకాలలో హైడ్రోజన్ పరమాణువులు నాలుగు, క్రియాజనకాలలో హైడ్రోజన్ పరమాణువులు 4 తో తుల్యం అయినవి. తరువాత ఆక్సిజన్ పరమాణువుల విషయానికొస్తే క్రియాజనకాలలో రెండు పరమాణువులు, క్రియాజన్యాలలో నాలుగు పరమాణువులు ఉన్నాయి. అపుడు ఎడమవైపు ఆక్సిజన్ అణువు (O2 ) ముందు 2 ఉంచినట్లైతే సమీకరణం క్రింది విధంగా వస్తుంది.
- CH4 + 2 O2 → CO2 + 2 H2O
ఇపుడు క్రియాజనకాలలో నాలుగు ఆక్సిజన్ పరమాణువులు, క్రియాజన్యాలలో నాలుగు ఆక్సిజన్ పరమాణువులు వచ్చినవి. తుల్యం అయినవి. మొత్తం మీద క్రియాజనకాలలోని అన్ని పరమాణువులు, క్రియాజన్యాలలోని పరమాణువులతో తుల్యం అయినవి. CH4, CO2 ల ముందు గుణకాలు 1 అని గమనించవలెను.
మూలాలు
[మార్చు]- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. ISBN 0-9678550-9-8.
- ↑ Crosland, M.P. (1959). "The use of diagrams as chemical 'equations' in the lectures of William Cullen and Joseph Black". Annals of Science. 15 (2): 75–90. doi:10.1080/00033795900200088.
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. ISBN 0-9678550-9-8.
- ↑ రసాయన సమీకరణాన్ని తుల్యం





