Aktinyum
 Bir viyaldeli bir miktar aktinyum-225 | |||||||||||||||||||||||||||
| Görünüş | gümüşi beyaz, mavi[1] ya da kimi zaman altın rengi bir ışıkla ışıldayan[2] | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Kütle numarası | [227] | ||||||||||||||||||||||||||
| Periyodik tablodaki yeri | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Atom numarası (Z) | 89 | ||||||||||||||||||||||||||
| Grup | n/a | ||||||||||||||||||||||||||
| Periyot | 7. periyot | ||||||||||||||||||||||||||
| Blok | f bloku | ||||||||||||||||||||||||||
| Elektron dizilimi | [Rn] 6d1 7s2 | ||||||||||||||||||||||||||
| Kabuk başına elektron | 2, 8, 18, 32, 18, 9, 2 | ||||||||||||||||||||||||||
| Fiziksel özellikler | |||||||||||||||||||||||||||
| Faz (SSB'de) | Katı | ||||||||||||||||||||||||||
| Erime noktası | 1500 K (1227 °C, 2240 °F)[2] (tahminî) | ||||||||||||||||||||||||||
| Kaynama noktası | 3500±300 K (3227±300 °C; 5840,6±500 °F)[2] (çıkarım) | ||||||||||||||||||||||||||
| Yoğunluk (OS) | 10 g/cm3 | ||||||||||||||||||||||||||
| Erime entalpisi | 14 kJ/mol | ||||||||||||||||||||||||||
| Buharlaşma entalpisi | 400 kJ/mol | ||||||||||||||||||||||||||
| Molar ısı kapasitesi | 27,2 J/(mol·K) | ||||||||||||||||||||||||||
| Atom özellikleri | |||||||||||||||||||||||||||
| Yükseltgenme durumları | +3 güçlü bazik | ||||||||||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 1,1 | ||||||||||||||||||||||||||
| İyonlaşma enerjileri |
| ||||||||||||||||||||||||||
| Kovalent yarıçapı | 215 pm | ||||||||||||||||||||||||||
| Diğer özellikleri | |||||||||||||||||||||||||||
| Doğal oluşum | Bozunma sonucu | ||||||||||||||||||||||||||
| Kristal yapı | Yüzey merkezli kübik (ymk) | ||||||||||||||||||||||||||
| Isı iletkenliği | 12 W/(m·K) | ||||||||||||||||||||||||||
| CAS Numarası | 7440-34-8 | ||||||||||||||||||||||||||
| Tarihi | |||||||||||||||||||||||||||
| Keşif ve ilk izolasyon | Friedrich Oskar Giesel (1902, 1903) | ||||||||||||||||||||||||||
| Adlandıran | André-Louis Debierne (1899) | ||||||||||||||||||||||||||
| Ana izotopları | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
Aktinyum, simgesi Ac ve atom numarası 89 olan kimyasal bir elementtir. İlk olarak 1899'da Fransız kimyager André-Louis Debierne tarafından izole edilmiştir.
Friedrich Oskar Giesel daha sonra 1902'de bağımsız olarak izole etti ve elementin bilindiğinden habersiz, ona "emanyum" adını verdi.[3] Aktinyum, periyodik tablodaki aktinyum ve lavrensiyum arasındaki 15 benzer elementten oluşan aktinit serisine isim verdi. Aynı zamanda, bazen 7. periyot geçiş metallerinin birincisi olarak kabul edilir, ancak lavrensiyum bu pozisyonda daha az görülür. Polonyum, radyum ve radon ile birlikte aktinyum, izole edilecek ilk ilkel olmayan radyoaktif elementlerden biriydi.
Yumuşak, gümüşi-beyaz bir radyoaktif metal olan aktinyum, havadaki oksijen ve nem ile hızla reaksiyona girerek daha fazla oksidasyonu önleyen beyaz bir aktinyum oksit kaplaması oluşturur. Çoğu lantanit ve birçok aktinitte olduğu gibi, aktinyum hemen hemen tüm kimyasal bileşiklerinde oksidasyon seviyesi +3 olarak görülür. Aktinyum, uranyum ve toryum cevherlerinde ağırlıklı olarak beta ve bazen alfa parçacıkları yayan 21.772 yıllık yarı ömüre sahip 227Ac izotopu ve 6.15 saatlik bir yarı ömre sahip beta aktif olan 228Ac olarak bulunur. Cevherdeki bir ton doğal uranyum yaklaşık 0.2 miligram aktinyum-227 içerir ve bir ton toryum yaklaşık 5 nanogram aktinyum-228 içerir. Aktinyum ve lantanın fiziksel ve kimyasal özelliklerinin yakın benzerliği, aktinyumun cevherden ayrılmasını pratik olmayan bir hale getirir. Bunun yerine aktinyum, bir nükleer reaktörde 226Ra'nın nötron ışınlaması ile miligram miktarlarında hazırlanır. Kıtlığı, yüksek fiyatı ve radyoaktivitesi nedeniyle, aktinyumun önemli bir endüstriyel kullanımı yoktur. Mevcut uygulamaları bir nötron kaynağı ve radyasyon terapisi için bir etken içerir.
Tarih
[değiştir | kaynağı değiştir]Fransız bir kimyager olan André-Louis Debierne, 1899'da yeni bir element keşfettiğini açıkladı. Marie ve Pierre Curie'nin radyumu çıkardıktan sonra bıraktığı uraninit kalıntılarından ayırdı. 1899'da Debierne, maddeyi titanyum[4] ve (1900'de) toryuma benzer olarak tanımladı.[5] Friedrich Oskar Giesel, 1902'de aktinyumu lantan benzeri bir madde olarak bağımsız olarak keşfetti[5] ve 1904'te buna "emanyum" adını verdi.[6] 1904'te Debierne, Harriet Brooks ve 1905'te Otto Hahn ve Otto Sackur tarafından belirlenen yarı ömürlerin karşılaştırılmasından sonra,[7] yeni element için Debierne'nin seçtiği isim, iddia ettiği çelişkili kimyasal özelliklere rağmen korundu.[7][8]
1970'lerde[9] ve daha sonra yayınlanan makaleler[10] Debierne'nin 1904'te yayınlanan sonuçlarının 1899 ve 1900'de bildirilenlerle çeliştiğini göstermektedir. Ayrıca, günümüzde bilinen aktinyum kimyası, Debierne'nin 1899 ve 1900 sonuçlarının küçük bir bileşeni dışında varlığını engeller; Aslında, rapor ettiği kimyasal özellikler, bunun yerine, on dört yıl boyunca keşfedilmeyecek olan yanlışlıkla protaktinyum tespit etmesini, sadece hidrolizi ve laboratuvar ekipmanına adsorpsiyonu nedeniyle ortadan kalkmasını mümkün kılmaktadır. Bu, bazı yazarların keşifle yalnızca Giesel'in kredilendirilmesi gerektiğini savunmasına yol açtı.[11] Bilimsel keşfin daha az çatışmacı bir vizyonu Adloff tarafından önerilmektedir.[10] Erken yayınlara yönelik eleştirilerin o zamanlar ortaya çıkan radyokimya tarafından hafifletilmesi gerektiğini öne sürüyor: Debierne'nin orijinal belgelerdeki iddialarının ihtiyatlılığını vurgulayarak, hiç kimsenin Debierne'nin maddesinin aktinyum içermediğini iddia edemeyeceğini belirtiyor.[10] Şu anda tarihçilerin büyük çoğunluğu tarafından keşfedici olarak kabul edilen Debierne, öğeye olan ilgisini kaybetti ve konuyu terk etti. Giesel ise radyokimyasal olarak saf aktinyumun ilk preparasyonu ve atom numarası 89'un tanımlanması ile haklı olarak kredilendirilebilir.[9]
Aktinyum adı Grekçe aktis, aktinos (ακτίς, ακτίνος), yani ışın anlamına gelir.[12] Ac sembolü, asetil, asetat[13] ve bazen asetaldehit gibi aktinyum ile ilgisi olmayan diğer bileşiklerin kısaltmalarında da kullanılır.[14]
Özellikler
[değiştir | kaynağı değiştir]Aktinyum yumuşak, gümüşi-beyaz,[15][16] radyoaktif, metalik bir elementtir. Tahmini kayma modülü kurşun ile benzerdir.[17] Güçlü radyoaktivitesi sayesinde aktinyum, yayılan enerjik parçacıklar tarafından iyonize edilen havadan kaynaklanan soluk mavi bir ışıkla karanlıkta parlar.[18] Aktinyum, lantan ve diğer lantanitlere benzer kimyasal özelliklere sahiptir ve bu nedenle uranyum cevherlerinden çıkarılırken bu elementlerin ayırılması zordur. Çözücü ayırması ve iyon kromatografisi ayırma için yaygın olarak kullanılır.[19]
Aktinitlerin ilk elementi olan aktinyum, lantanın lantanitlere yaptığı gibi gruba adını verdi. Element grubu lantanitlerden daha çeşitlidir ve bu nedenle 1945'e kadar Dmitri Mendeleev'in periyodik tablosundaki en önemli değişikliğin lantanitlerin tanınması, aktinitlerin tanıtılması, genellikle Glenn T. Seaborg'un transuranyum elementleri üzerinde yaptığı araştırmalarından sonra kabul edildi (1892'de İngiliz kimyager Henry Bassett tarafından önerilmiş olmasına rağmen).[20]
Aktinyum, havadaki oksijen ve nem ile hızla reaksiyona girerek daha fazla oksidasyonu engelleyen beyaz bir aktinyum oksit kaplaması oluşturur.[15] Çoğu lantanit ve aktinitte olduğu gibi, aktinyum +3 oksidasyon seviyesinde bulunur ve Ac3+ iyonları çözeltilerde renksizdir.[21] +3 oksidasyon seviyesi soy gaz radonun kararlı kapalı-kabuk yapısını vermek için kolayca bağışlanan üç değerlik elektronu ile aktinyumun [Rn]6d17s2 elektronik konfigürasyonundan kaynaklanır.[16] Nadir +2 oksidasyon seviyesi sadece aktinyum dihidrit (AcH2) için bilinir; hatta bu gerçekte daha hafif konjeni LaH2 gibi bir elektrür bileşiği olabilir ve dolayısıyla aktinyum(III) içerebilir.[21] Ac3+ bilinen tüm tripositif iyonların en büyüğüdür ve ilk koordinasyon küresi yaklaşık 10.9 ± 0.5 su molekülü içerir.[21]
Kimyasal bileşikler
[değiştir | kaynağı değiştir]Aktinyumun yoğun radyoaktivitesi nedeniyle, sadece sınırlı sayıda aktinyum bileşiği bilinmektedir. Bunlar şunları içerir: AcF3, AcCl3, AcBr3, AcOF, AcOCl, AcOBr, Ac2S3, Ac2O3 ve AcPO4. AcPO4 hariç hepsi ilgili lantan bileşiklerine benzer. Hepsi +3 oksidasyon seviyesinde aktinyum içerir.[21][22] Özellikle, analog lantan ve aktinyum bileşiklerinin kafes sabitleri sadece yüzde birkaç oranında farklılık gösterir.[22]
| Formül | renk | simetri | Uzay grubu | No | Pearson sembolü | a (pm) | b (pm) | c (pm) | Z | yoğunluk, g/cm3 |
|---|---|---|---|---|---|---|---|---|---|---|
| Ac | gümüşi | fcc | Fm3m | 225 | cF4 | 531.1 | 531.1 | 531.1 | 4 | 10.07 |
| AcH2 | bilinmiyor | kübik | Fm3m | 225 | cF12 | 567 | 567 | 567 | 4 | 8.35 |
| Ac2O3 | beyaz | trigonal | P3m1 | 164 | hP5 | 408 | 408 | 630 | 1 | 9.18 |
| Ac2S3 | siyah | kübik | I43d | 220 | cI28 | 778.56 | 778.56 | 778.56 | 4 | 6.71 |
| AcF3 | beyaz | hegzagonal | P3c1 | 165 | hP24 | 741 | 741 | 755 | 6 | 7.88 |
| AcCl3 | beyaz | hegzagonal | P63/m | 165 | hP8 | 764 | 764 | 456 | 2 | 4.8 |
| AcBr3 | beyaz | hegzagonal | P63/m | 165 | hP8 | 764 | 764 | 456 | 2 | 5.85 |
| AcOF | beyaz | kübik | Fm3m | 593.1 | 8.28 | |||||
| AcOCl | beyaz | tetragonal | 424 | 424 | 707 | 7.23 | ||||
| AcOBr | beyaz | tetragonal | 427 | 427 | 740 | 7.89 | ||||
| AcPO4·0.5H2O | bilinmiyor | hegzagonal | 721 | 721 | 664 | 5.48 |
Burada a, b ve c kafes sabitleridir, No boşluk grubu sayısı ve Z birim hücre başına formül birimi sayısıdır. Yoğunluk doğrudan ölçülmedi, kafes parametrelerinden hesaplandı.
Oksitler
[değiştir | kaynağı değiştir]Aktinyum oksit (Ac2O3), hidroksitin 500 °C'de veya oksalatın 1100 °C'de vakumla ısıtılmasıyla elde edilebilir. Kristal kafesi, en üç değerlikli nadir toprak metallerinin oksitleri ile izotipiktir.[22]
Halitler
[değiştir | kaynağı değiştir]Aktinyum triflorür, çözeltide veya katı reaksiyonda üretilebilir. Önceki reaksiyon, aktinyum iyonları içeren bir çözeltiye hidroflorik asit ilave edilerek oda sıcaklığında gerçekleştirilir. İkinci yöntemde, aktinyum metali, platin bir düzenekte 700 °C'de hidrojen florür buharları ile işlenir. Aktinyum triflorürün 900-1000 °C'de amonyum hidroksit ile işlenmesi oksiflorür AcOF verir. Lantan oksiflorür, bir saat boyunca 800 °C'de havada lantan triflorür yakılarak kolayca elde edilebilirken, aktinyum triflorürün benzer şekilde işlenmesi AcOF vermez ve sadece başlangıçtaki ürünün erimesiyle sonuçlanır.[22][23]
- AcF3 + 2 NH3 + H2O → AcOF + 2 NH4F
Aktinyum triklorür, aktinyum hidroksit veya oksalatın 960 °C'nin üzerindeki sıcaklıklarda karbon tetraklorür buharları ile reaksiyona sokulmasıyla elde edilir. Oksiflorür gibi aktinyum oksiklorür, aktinyum triklorürün 1000 °C'de amonyum hidroksit ile hidrolize edilmesi suretiyle hazırlanabilir. Bununla birlikte, oksiflorürün aksine, oksiklorür hidroklorik asit içindeki bir aktinyum triklorür çözeltisinin amonyak ile tutuşturulmasıyla sentezlenebilir.[22]
Alüminyum bromür ve aktinyum oksit reaksiyonu aktinyum tribromür verir:
- Ac2O3 + 2 AlBr3 → 2 AcBr3 + Al2O3
ve 500 °C'de amonyum hidroksit ile muamele edilmesi oksibromit AcOBr ile sonuçlanır.[22]
Diğer bileşikler
[değiştir | kaynağı değiştir]Aktinyum hidrür, aktinyum triklorürün potasyum ile 300 °C'de indirgenmesiyle elde edildi ve yapısı, karşılık gelen LaH2 hidrür ile benzer şekilde çıkarıldı. Reaksiyondaki hidrojen kaynağı belirsizdi.[24]
Monosodyum fosfatın (NaH2PO4) hidroklorik asit içindeki bir aktinyum çözeltisi ile karıştırılması, birkaç dakika boyunca beyaz renkli aktinyum fosfat hemihidrat (AcPO4·0.5H2O) ile ısıtılır ve aktinyum oksalat, siyah aktinyum sülfür (Ac2S3) ile sonuçlanır. Muhtemelen 1000 °C'de aktinyum oksit üzerinde bir hidrojen sülfür ve karbon disülfür karışımı ile hareket ettirilerek üretilebilir.[22]
İzotoplar
[değiştir | kaynağı değiştir]Doğal olarak oluşan aktinyum, iki radyoaktif izotoptan oluşur; 227Ac (235U radyoaktif ailesinden) ve 228Ac). 227Ac esas olarak çok küçük bir enerjiye sahip bir beta yayıcı olarak bozunur, ancak olayların %1.38'inde bir alfa parçacığı yayar, böylece alfa spektrometresi ile kolayca tanımlanabilir.[11] En kararlı olanı 21.772 yıl yarı ömrü olan 227Ac, 10 gün yarı ömüre sahip 225Ac ve 29.37 saat yarı ömüre sahip 226Ac olmak üzere otuz altı radyoizotop tespit edilmiştir. Geriye kalan tüm radyoaktif izotopların yarı ömürleri 10 saatten azdır ve çoğunun yarı ömürleri bir dakikadan kısadır. Bilinen en kısa aktinyum izotopu, alfa bozunması ile bozunan 227Ac'dir (69 nanosaniyelik yarı ömür). Aktinyum bilinen iki meta duruma sahiptir. Kimya için en önemli izotoplar 225Ac, 227Ac ve 228Ac'dir.[11]
Saflaştırılmış 227Ac, yaklaşık yarım yıl sonra bozunma ürünleri ile dengeye gelir. Çoğunlukla beta (%98.62) ve bazı alfa parçacıklarına (%1.38) yayılan 21.772 yıllık yarı ömrüne göre bozunur; ardışık bozunma ürünleri aktinyum serisinin bir parçasıdır. Mevcut düşük miktarlar, beta parçacıklarının düşük enerjisi (maksimum 44.8 keV) ve düşük alfa radyasyon yoğunluğu nedeniyle, 227Ac emisyonu ile doğrudan tespit etmek zordur ve bu nedenle çürüme ürünleri ile izlenir.[21] Aktinyum izotopları atom ağırlığında 205 u (205Ac) ila 236 u (236Ac) arasında değişir.
| İzotop | Üretim | Bozunma | Yarı ömür |
|---|---|---|---|
| 221Ac | 232Th(d,9n)→225Pa( |
52 ms | |
| 222Ac | 232Th(d,8n)→226Pa( |
5.0 s | |
| 223Ac | 232Th(d,7n)→227Pa( |
2.1 min | |
| 224Ac | 232Th(d,6n)→228Pa( |
2.78 saat | |
| 225Ac | 232Th(n, |
10 gün | |
| 226Ac | 226Ra(d,2n)→226Ac | elektron yakalanması |
29.37 saat |
| 227Ac | 235U( |
21.77 yıl | |
| 228Ac | 232Th( |
6.15 saat | |
| 229Ac | 228Ra(n, |
62.7 min | |
| 230Ac | 232Th(d, |
122 s | |
| 231Ac | 232Th( |
7.5 min | |
| 232Ac | 232Th(n,p)→232Ac | 119 s |
Oluşum ve sentez
[değiştir | kaynağı değiştir]
Aktinyum sadece uranyum cevherlerindeki izlerde bulunur - cevherdeki bir ton uranyum yaklaşık 0.2 miligram 227Ac içerir[25] - ve bir ton toryum başına yaklaşık 5 nanogram 228Ac içeren toryum cevherlerinde bulunur. 227Ac, ana izotop 235U (veya 239Pu) ile başlayan ve kararlı kurşun izotop 207Pb ile biten uranyum-aktinyum serisi bozunma zincirinin geçici bir üyesidir. İzotop 228Ac, ana izotop 232Th ile başlayan ve kararlı kurşun izotop 208Pb ile biten toryum serisi bozunma zincirinin geçici bir üyesidir. 237Np (veya 233U) ile başlayan ve talyum (205Tl) ve neredeyse kararlı bizmut (209Bi) ile biten başka bir aktinyum izotopu (225Ac) geçici olarak neptunyum serisi bozunma zincirinde bulunur; tüm ilkel 237Np bozulmasına rağmen, sürekli olarak doğal 238U üzerindeki nötron nakavt reaksiyonları ile üretilir.
Düşük doğal konsantrasyon ve fiziksel ve kimyasal özelliklerin aktinyum taşıyan cevherlerde her zaman bol olan lantan ve diğer lantanitler ile benzerliği, aktinyumun cevherden pratik olarak ayrılmasını sağlamaz ve hiçbir zaman tam bir ayırma elde edilemez.[22] Bunun yerine aktinyum, bir nükleer reaktörde 226Ra'nın nötron ışınlaması ile miligram miktarlarında hazırlanır.[26]
Reaksiyon verimi radyum ağırlığının yaklaşık %2'sidir. 227Ac, daha az miktarda 228Ac ile sonuçlanan nötronları daha fazla yakalayabilir. Sentezden sonra, aktinyum radyumdan ve toryum, polonyum, kurşun ve bizmut gibi çürüme ve nükleer füzyon ürünlerinden ayrılır. Ekstraksiyon, radyasyon ürünlerinin sulu bir çözeltisinden tenoiltrifloroaseton-benzen çözeltisi ile gerçekleştirilebilir ve belirli bir elemente seçicilik, pH ayarlanarak (aktinyum için yaklaşık 6.0'a kadar) elde edilir.[25] Alternatif bir prosedür, iki aşamalı bir işlemde radyum ve aktinyum ve toryum için 1.000.000 ayırma faktörüne yol açabilen nitrik asit içinde uygun bir reçine ile anyon değişimidir. Aktinyum daha sonra düşük bir çapraz bağlanan katyon değişim reçinesi ve elüent olarak nitrik asit kullanılarak yaklaşık 100 oranında radyumdan ayrılabilir.[27]
225Ac ilk olarak bir siklotron kullanarak Almanya'daki Transuranyum Elementler Enstitüsü'nde (ITU) yapay olarak ve 2000 yılında bir parçacık hızlandırıcı kullanılarak Sydney'deki St George Hastanesi'nde üretildi.[28] Bu nadir izotop, radyasyon terapisinde potansiyel uygulamalara sahiptir ve en etkili şekilde 20-30 MeV döteryum iyonuyla bir radyum-226 hedefinin bombardımanı ile üretilir. Bu reaksiyon aynı zamanda 226Ac verir, bununla birlikte 29 saatlik yarı ömürle bozunur ve dolayısıyla 225Ac'yi kirletmez.[29]
Aktinyum metali, aktinyum florürünün lityum buharı ile vakumda 1100 ila 1300 °C arasındaki bir sıcaklıkta indirgenmesiyle hazırlanmıştır. Yüksek sıcaklıklar ürünün buharlaşmasına neden olurken, düşük sıcaklıklar eksik bir dönüşüme yol açar. Lityum, diğer alkali metaller arasından seçilmiştir çünkü florürü en uçucudur.[12][15]
Uygulamalar
[değiştir | kaynağı değiştir]Kıtlığı, yüksek fiyatı ve radyoaktivitesi nedeniyle, 227Ac şu anda önemli bir endüstriyel kullanıma sahip değildir, ancak 225Ac şu anda hedefli alfa terapileri gibi kanser tedavilerinde kullanılmak üzere araştırılmaktadır.[12][30] 227Ac oldukça radyoaktiftir ve bu nedenle örneğin uzay aracında radyoizotop termoelektrik jeneratörlerinin aktif bir elemanı olarak kullanılmak üzere incelenmiştir. Berilyum ile preslenmiş 227Ac oksit, aynı zamanda, standart amerikyum-berilyum ve radyum-berilyum çiftlerinin aktivitesini aşan etkin bir nötron kaynağıdır.[31] Tüm bu uygulamalarda, 227Ac (bir beta kaynağı) sadece bozunması üzerine alfa yayan izotoplar üreten bir progenitördür. Berilyum, (
227AcBe nötron kaynakları, bir nötron probuna uygulanabilir - toprakta bulunan su miktarını ve karayolu yapımında kalite kontrolü için nem / yoğunluk miktarını ölçmek için standart bir cihaz.[32][33] Bu problar ayrıca kuyu loglama uygulamalarında, nötron radyografisinde, tomografide ve diğer radyokimyasal araştırmalarda kullanılır.[34]
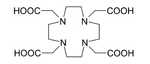
225Ac, yeniden kullanılabilir bir jeneratörde 213Bi üretmek için tıpta uygulanır[27] veya radyasyon terapisi için bir ajan olarak, özellikle hedeflenmiş alfa terapisinde (TAT) tek başına kullanılabilir. Bu izotopun yarı ömrü 10 gündür, bu da radyasyon tedavisi için 213Bi'den (yarı ömrü 46 dakika)[30] çok daha uygundur. Ek olarak 225Ac, diğer aday izotopların, yani 227Th, 228Th ve 230U'nun bozunma zincirlerinde nihai ürün olan, kararlı ancak toksik kurşun yerine toksik olmayan 209Bi'ye bozunur.[30] Sadece 225Ac'ın kendisi değil, bağları da vücuttaki kanser hücrelerini öldüren alfa parçacıkları yayar. 225Ac'nin uygulanmasındaki en büyük zorluk, basit aktinyum komplekslerinin intravenöz enjeksiyonunun onlarca yıl boyunca kemiklerde ve karaciğerde birikmesine yol açmasıydı. Sonuç olarak, kanser hücreleri 225Ac'den alfa parçacıkları tarafından hızla öldürüldükten sonra, aktinyum ve bağlarından gelen radyasyon yeni mutasyonlara neden olabilir. Bu sorunu çözmek için 225Ac, sitrat, etilendiamintetraasetik asit (EDTA) veya dietilen triamin pentaasetik asit (DTPA) gibi bir şelatlama maddesine bağlandı. Bu, kemiklerde aktinyum birikimini azalttı, ancak vücuttan atılım yavaş kaldı. HEHA (1,4,7,10,13,16-heksaazasikloheksadekan-N, N′, N″, N‴, N‴′, N‴″ - heksaasetik asit)[35] veya DOTA gibi şelatlayıcı ajanlarla çok daha iyi sonuçlar elde edildi. HER2/neu reseptörüne müdahale eden bir monoklonal antikor olan trastuzumab'a bağlanan (1,4,7,10-tetraazasiklododekan-1,4,7,10-tetraasetik asit). İkinci uygulama kombinasyonu fareler üzerinde test edildi ve lösemi, lenfoma, göğüs, yumurtalık, nöroblastom ve prostat kanserlerine karşı etkili olduğu kanıtlandı.[36][37][38]
227Ac'nin (21.77 yıl) orta yarı ömrü, okyanus sularının yavaş dikey karışmasının modellenmesinde çok uygun radyoaktif izotop olmasını sağlar. İlgili süreçler, mevcut hızların (yılda 50 metre) doğrudan ölçümleri ile gerekli doğrulukla incelenemez. Bununla birlikte, farklı izotoplar için konsantrasyon derinliği profillerinin değerlendirilmesi, karıştırma oranlarının tahmin edilmesini sağlar. Bu yöntemin arkasındaki fizik bunun gibidir: okyanus suları homojen olarak dağılmış 235U içerir. Bozunma ürünü, 231Pa, yavaş yavaş dibe çöker, böylece konsantrasyonu önce derinlikle artar ve sonra neredeyse sabit kalır. 231Pa, 227Ac'ye bozunur; bununla birlikte, ikinci izotopun konsantrasyonu 231Pa derinlik profilini izlemez, bunun yerine deniz tabanına doğru artar. Bu, deniz tabanından ilave 227Ac yükselten karıştırma işlemleri nedeniyle oluşur. Bu nedenle, 231Pa ve 227Ac derinlik profillerinin analizi, araştırmacıların karıştırma davranışını modellemesine olanak tanır.[39][40]
AcHx hidritlerin (bu durumda çok yüksek basınçla), Tc'nin H3S'den önemli ölçüde daha yüksek, muhtemelen 250 K civarında olduğu için oda sıcaklığına yakın bir süper iletken için aday olduğuna dair teorik tahminler vardır.[41]
Önlemler
[değiştir | kaynağı değiştir]227Ac son derece radyoaktiftir ve bununla ilgili deneyler sıkı bir eldiven kutusu ile donatılmış özel olarak tasarlanmış bir laboratuvarda gerçekleştirilir. Aktinyum triklorür sıçanlara intravenöz olarak uygulandığında, aktinyumun yaklaşık %33'ü kemiklere ve %50'si karaciğere birikir. Toksisitesi amerikyum ve plütonyum ile karşılaştırılabilir, ancak biraz daha düşüktür.[42] Eser miktarlar için, iyi havalandırmalı çeker ocaklar yeterlidir; gram miktarları için, 227Ac tarafından yayılan yoğun gama radyasyonundan kalkan sıcak hücreler gereklidir.[42]
Kaynakça
[değiştir | kaynağı değiştir]- ^ Wall, Greg (8 Eylül 2003). "C&EN: It's Elemental: The Periodic Table - Actinium". C&EN: It's Elemental: The Periodic Table. Chemical and Engineering News. 11 Ekim 2003 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Haziran 2011.
- ^ a b c Kirby, Harold W.; Morss, Lester R. (2006). "Actinium". The Chemistry of the Actinide and Transactinide Elements. s. 18. doi:10.1007/1-4020-3598-5_2. ISBN 978-1-4020-3555-5.
- ^ "Actinium - Element information, properties and uses". Royal Society of Chemistry. 24 Ocak 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Ekim 2018.
- ^ Debierne, André-Louis (1899). "Sur un nouvelle matière radio-active". Comptes Rendus (Fransızca). Cilt 129. ss. 593-595. 7 Mayıs 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2020.
- ^ a b Debierne, André-Louis (1900–1901). "Sur un nouvelle matière radio-actif – l'actinium". Comptes Rendus (Fransızca). Cilt 130. ss. 906-908. 26 Nisan 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2020.
- ^ Giesel, Friedrich Oskar (1904). "Ueber den Emanationskörper (Emanium)". Berichte der Deutschen Chemischen Gesellschaft (Almanca). 37 (2). ss. 1696-1699. doi:10.1002/cber.19040370280. 7 Mayıs 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2020.
- ^ a b Debierne, André-Louis (1904). "Sur l'actinium". Comptes Rendus (Fransızca). Cilt 139. ss. 538-540.
- ^ Giesel, Friedrich Oskar (1905). "Ueber Emanium". Berichte der Deutschen Chemischen Gesellschaft (Almanca). 38 (1). ss. 775-778. doi:10.1002/cber.190503801130.
- ^ a b Kirby, Harold W. (1971). "The Discovery of Actinium". Isis. 62 (3). ss. 290-308. doi:10.1086/350760. JSTOR 229943.
- ^ a b c Adloff, J. P. (2000). "The centenary of a controversial discovery: actinium". Radiochim. Acta. 88 (3–4_2000). ss. 123-128. doi:10.1524/ract.2000.88.3-4.123.
- ^ a b c Kirby, Harold W.; Morss, Lester R. (2006). "Actinium". The Chemistry of the Actinide and Transactinide Elements. p. 18. doi:10.1007/1-4020-3598-5_2. ISBN 978-1-4020-3555-5.
- ^ a b c Hammond, C. R. The Elements in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Gilley, Cynthia Brooke; University of California, San Diego. Chemistry (2008). New convertible isocyanides for the Ugi reaction; application to the stereoselective synthesis of omuralide. s. 11. ISBN 978-0-549-79554-4.[ölü/kırık bağlantı]
- ^ Reimers, Jeffrey R. (2011). Computational Methods for Large Systems: Electronic Structure Approaches for Biotechnology and Nanotechnology. John Wiley and Sons. s. 575. ISBN 978-0-470-48788-4.
- ^ a b c Stites, Joseph G.; Salutsky, Murrell L.; Stone, Bob D. (1955). "Preparation of Actinium Metal". J. Am. Chem. Soc. 77 (1). ss. 237-240. doi:10.1021/ja01606a085.
- ^ a b Actinium, in Encyclopædia Britannica, 15th edition, 1995, p. 70
- ^ Seitz, Frederick and Turnbull, David (1964) Solid state physics: advances in research and applications 8 Mayıs 2020 tarihinde Wayback Machine sitesinde arşivlendi.. Academic Press. 0-12-607716-9 pp. 289–291
- ^ Richard A. Muller (2010). Physics and Technology for Future Presidents: An Introduction to the Essential Physics Every World Leader Needs to Know. Princeton University Press. ss. 136-. ISBN 978-0-691-13504-5.
- ^ Katz, J. J.; Manning, W. M. (1952). "Chemistry of the Actinide Elements Annual Review of Nuclear Science". Annual Review of Nuclear Science. Cilt 1. ss. 245-262. Bibcode:1952ARNPS...1..245K. doi:10.1146/annurev.ns.01.120152.001333.
- ^ Seaborg, Glenn T. (1946). "The Transuranium Elements". Science. 104 (2704). ss. 379-386. Bibcode:1946Sci...104..379S. doi:10.1126/science.104.2704.379. JSTOR 1675046. PMID 17842184.
- ^ a b c d e Actinium 14 Aralık 2013 tarihinde Wayback Machine sitesinde arşivlendi., Great Soviet Encyclopedia (in Russian)
- ^ a b c d e f g h Fried, Sherman; Hagemann, French; Zachariasen, W. H. (1950). "The Preparation and Identification of Some Pure Actinium Compounds". Journal of the American Chemical Society. 72 (2). ss. 771-775. doi:10.1021/ja01158a034.
- ^ Meyer, pp. 87–88
- ^ Meyer, p. 43
- ^ a b Hagemann, French (1950). "The Isolation of Actinium". Journal of the American Chemical Society. 72 (2). ss. 768-771. doi:10.1021/ja01158a033.
- ^ Emeleus, H. J. (1987). Advances in inorganic chemistry and radiochemistry. Academic Press. ss. 16-. ISBN 978-0-12-023631-2.
- ^ a b Bolla, Rose A.; Malkemus, D.; Mirzadeh, S. (2005). "Production of actinium-225 for alpha particle mediated radioimmunotherapy". Applied Radiation and Isotopes. 62 (5). ss. 667-679. doi:10.1016/j.apradiso.2004.12.003. PMID 15763472.
- ^ Melville, G; Allen, Bj (2009). "Cyclotron and linac production of Ac-225". Applied Radiation and Isotopes. 67 (4). ss. 549-55. doi:10.1016/j.apradiso.2008.11.012. PMID 19135381.
- ^ Russell, Pamela J.; Jackson, Paul and Kingsley, Elizabeth Anne (2003) Prostate cancer methods and protocols 30 Nisan 2016 tarihinde Wayback Machine sitesinde arşivlendi.. Humana Press. 0-89603-978-1, p. 336
- ^ a b c Deblonde, Gauthier J.-P.; Abergel, Rebecca J. (21 Ekim 2016). "Active actinium". Nature Chemistry (İngilizce). 8 (11). s. 1084. Bibcode:2016NatCh...8.1084D. doi:10.1038/nchem.2653
 . ISSN 1755-4349. OSTI 1458479
. ISSN 1755-4349. OSTI 1458479  . PMID 27768109.
. PMID 27768109.
- ^ Russell, Alan M. and Lee, Kok Loong (2005) Structure-property relations in nonferrous metals 9 Mayıs 2020 tarihinde Wayback Machine sitesinde arşivlendi.. Wiley. 0-471-64952-X, pp. 470–471
- ^ Majumdar, D. K. (2004) Irrigation Water Management: Principles and Practice 10 Mayıs 2020 tarihinde Wayback Machine sitesinde arşivlendi.. 81-203-1729-7 p. 108
- ^ Chandrasekharan, H. and Gupta, Navindu (2006) Fundamentals of Nuclear Science – Application in Agriculture 8 Mayıs 2020 tarihinde Wayback Machine sitesinde arşivlendi.. 81-7211-200-9 pp. 202 ff
- ^ Dixon, W. R.; Bielesch, Alice; Geiger, K. W. (1957). "Neutron Spectrum of an Actinium–Beryllium Source". Can. J. Phys. 35 (6). ss. 699-702. Bibcode:1957CaJPh..35..699D. doi:10.1139/p57-075.
- ^ Deal K.A.; Davis I.A.; Mirzadeh S.; Kennel S.J.; Brechbiel M.W. (1999). "Improved in Vivo Stability of Actinium-225 Macrocyclic Complexes". J Med Chem. 42 (15). ss. 2988-9. doi:10.1021/jm990141f. PMID 10425108.
- ^ McDevitt, Michael R.; Ma, Dangshe; Lai, Lawrence T.; Simon, Jim; Borchardt, Paul; Frank, R. Keith; Wu, Karen; Pellegrini, Virginia; Curcio, Michael J.; Miederer, Matthias; Bander, Neil H.; Scheinberg, David A. (2001). "Tumor Therapy with Targeted Atomic Nanogenerators". Science. 294 (5546). ss. 1537-1540. Bibcode:2001Sci...294.1537M. doi:10.1126/science.1064126. PMID 11711678.
- ^ Borchardt, Paul E. (2003). "Targeted Actinium-225 in Vivo Generators for Therapy of Ovarian Cancer" (PDF). Cancer Research. 63 (16). ss. 5084-5090. PMID 12941838. 10 Temmuz 2019 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 6 Mayıs 2020.
- ^ Ballangrud, A. M. (2004). "Alpha-particle emitting atomic generator (Actinium-225)-labeled trastuzumab (herceptin) targeting of breast cancer spheroids: efficacy versus HER2/neu expression". Clinical Cancer Research. 10 (13). ss. 4489-97. doi:10.1158/1078-0432.CCR-03-0800
 . PMID 15240541.
. PMID 15240541.
- ^ Nozaki, Yoshiyuki (1984). "Excess 227Ac in deep ocean water". Nature. 310 (5977). ss. 486-488. Bibcode:1984Natur.310..486N. doi:10.1038/310486a0.
- ^ Geibert, W.; Rutgers Van Der Loeff, M. M.; Hanfland, C.; Dauelsberg, H.-J. (2002). "Actinium-227 as a deep-sea tracer: sources, distribution and applications". Earth and Planetary Science Letters. 198 (1–2). ss. 147-165. Bibcode:2002E&PSL.198..147G. doi:10.1016/S0012-821X(02)00512-5. 13 Mayıs 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2020.
- ^ Semenok, Dmitrii V.; Kvashnin, Alexander G.; Kruglov, Ivan A.; Oganov, Artem R. (19 Nisan 2018). "Actinium hydrides AcH10, AcH12, AcH16 as high-temperature conventional superconductors". The Journal of Physical Chemistry Letters. 9 (8). ss. 1920-1926. arXiv:1802.05676 $2. doi:10.1021/acs.jpclett.8b00615. ISSN 1948-7185. PMID 29589444.
- ^ a b Langham, W.; Storer, J. (1952). "Toxicology of Actinium Equilibrium Mixture". Los Alamos Scientific Lab.: Technical Report. doi:10.2172/4406766. 9 Mayıs 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2020.
Dış bağlantılar
[değiştir | kaynağı değiştir]- Actinium 9 Mayıs 2020 tarihinde Wayback Machine sitesinde arşivlendi. at The Periodic Table of Videos (University of Nottingham)
- NLM Hazardous Substances Databank – Actinium, Radioactive15 Nisan 2016 tarihinde Wayback Machine sitesinde arşivlendi.
- Actinium in {{Kitap kaynağı |isbn=978-1-4020-3555-5|başlık=The Chemistry of the Actinide and Transactinide Elements|editör1-soyadı=Morss|editör2-ad=Norman M.|editör2-soyadı=Edelstein|editör3-soyadı=Fuger|editör3-ad=Jean|soyadı1=Kirby|ad1=H. W.|soyadı2=Morss|ad2=L. R.|yayıncı=Springer|tarih=2006|yer=Dordrecht, The Netherlands|basım=3.3



![{\displaystyle {\ce {^{226}_{88}Ra + ^{1}_{0}n -> ^{227}_{88}Ra ->[\beta^-][42.2 \ {\ce {min}}] ^{227}_{89}Ac}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0971e4ce21fbf7bb4673856bff635b1a64d11fb2)
