Kimyasal bağ
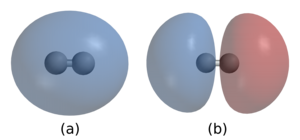

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.
Kimyasal bağ, atomları birbirine bağlayan ve bir arada kalmalarını sağlayan kuvvetlere verilen bilimsel ad.[1]
Zıt elektrik yükleri birbirini çektiğinden, çekirdeği çevreleyen negatif yüklü elektronlar ile çekirdeğin içindeki pozitif yüklü protonlar birbirini çeker. İki çekirdek arasında paylaşılan elektronlar her ikisine de çekilir. "Yapıcı kuantum mekaniksel dalga fonksiyonu girişimi"[2] eşleştirilmiş çekirdekleri dengeler (bkz. Kimyasal bağlanma teorileri).
Bağlı çekirdekler, kuantum teorisi tarafından niceliksel olarak açıklanan çekici ve itici etkileri dengeleyen optimal bir mesafeyi (bağ mesafesi) korur.[3][4]
Moleküller, kristaller, metaller ve diğer madde formlarındaki atomlar, maddenin yapısını ve özelliklerini belirleyen kimyasal bağlarla bir arada tutulur.
Tüm bağlar kuantum teorisiyle açıklanabilir, ancak pratikte basitleştirilmiş kurallar ve diğer teoriler kimyagerlerin bağların gücünü, yönünü ve polaritesini tahmin etmesine olanak tanır.[5] Oktet kuralı ve VSEPR teorisi örnektir.
Daha karmaşık teoriler, yörünge hibridizasyonu [6] ve rezonansı [7] içeren değerlik bağı teorisi ve atomik yörüngeler ile ligand alan teorisinin doğrusal kombinasyonunu içeren moleküler yörünge teorisidir [8]. Elektrostatik, bağ polaritelerini ve bunların kimyasal maddeler üzerindeki etkilerini tanımlamak için kullanılır.
Kimyasal bir bağın oluşması ve özellikleri
[değiştir | kaynağı değiştir]Bir bağın oluşabilmesi için atomlar tek başına bulundukları zamankinden daha kararlı (az enerjiye sahip) olmalıdırlar. Genelleme yapmak gerekirse bağlar oluşurken dışarıya enerji verirler. Atomlar bağ yaparken, elektron dizilişlerini soygazlara benzetmeye çalışırlar. Bir atomun yapabileceği bağ sayısı, sahip olduğu veya az enerji ile sahip olabileceği yarı dolu orbital sayısına eşittir.
Atomlar birleştiği zaman elektron dağılımındaki değişmelerin bir sonucu olarak kimyasal bağlar meydana gelir. Üç çeşit temel bağ vardır. Bu üç bağ çeşidi şunlardır:[1]
- İyonik bağlar, elektronlar bir atomdan diğerine aktarıldığı zaman meydana gelen bağlara verilen addır. Tepkimeye giren elementlerden birinin atomları, elektron kaybedip pozitif yüklü iyonlara dönüşürken diğer elementin atomları elektron kazanıp negatif yüklü iyon oluştururlar. Böylece zıt (artı-eksi) bir şekilde yüklenmiş iyonlar arasındaki elektrostatik çekim kuvveti, söz konusu iyonları bir kristal içinde tutar.
- Kovalent bağlar, elektronların bir atomdan diğerine aktarılmaksızın ortaklaşa kullanıldığı bağlara denir. Tek kovalent bağ, iki atom tarafından bölünmüş yani ortaklaşa kullanılan bir elektron çiftinden ibarettir. Moleküller birbirlerine kovalent bağlarla bağlanmış atomlardan meydana gelir.
- Metalik bağlar, metal ve alaşımlarda bulunan bağlardır. Metal atomları üç boyutlu bir yapı içinde düzenlenirler. Bu atomların en dış elektronları, yapının her tarafında serbestçe dolaşır ve atomların birbirlerine bağlanmasını sağlarlar.
İyonik Bağ
[değiştir | kaynağı değiştir]Metal ve ametal atomları arasında elektron alışverişi ile oluşan kimyasal bağ, iyonik bağdır. Bileşik oluşurken metal elektron verir, ametal de elektron alır.
Atomlardan elektron kaybıyla oluşan pozitif iyonlara katyon denir. Atomların elektron kazanarak oluşturdukları negatif iyonlar ise anyon olarak isimlendirilir. Bu iyonlar bir araya getirildiklerinde bir kristal oluşturmak üzere birbirlerini çekerler.
A gruplarındaki elementlerin bileşikleri çoğu kez elementlerin simgeleri ile birlikte değerlik elektronlarını gösteren noktalar kullanılarak ifade edilir. Değerlik elektronları baş grup (A grubu) elementlerinin kimyasal tepkimelerinde kullanılan elektronlardır.
Örneğin; bir sodyum atomu ile bir klor atomu arasındaki tepkimeyi ele alalım:
Sodyum 1A grubunda olup sadece bir değerlik elektronuna sahiptir. Klor atomu ise 7A grubunun bir üyesi olduğundan 7 değerlik elektronuna sahiptir. Bu iki atom arasındaki tepkimede sodyum atomu 1 elektron kaybeder. Sodyum atomunun kaybetmiş olduğu elektron klor atomu tarafından kazanılır.
Sodyum çekirdeği 11 proton (11+ yük) ve sodyum iyonu da yalnız 10 elektron (bir elektron kaybetmiş oluyor) içerdiğinden sodyum atomunun bir elektron kaybetmesiyle 1+ yüklü sodyum iyonu oluşur. Diğer taraftan, klor çekirdeği 17 proton (17+ yük) ve klor iyonu da 18 elektron (bir elektron kazanılmış oluyor) içerdiğinden klor atomunun bir elektron kazanmasıyla da 1- yüklü bir klorür iyonu meydana gelir.
Sonuç: Görüldüğü gibi, bu tepkimede, sodyum tarafından kaybedilen elektronların toplam sayısı klor tarafından kazanılan elektronların toplam sayısına eşit olmalıdır. Böylece oluşan sodyum iyonlarının sayısı ile meydana gelen klorür iyonlarının sayısı aynı olduğundan NaCl formülü bileşikte bulunan iyonların en basit oranını (1:1) verir. Bu iyonlar bir kristal oluşturmak üzere birbirini çekerler.
Sodyum klorür kristalinde bir iyonun tümüyle diğer bir iyona ait olduğu söylenemez. Aksine, kristal yapıda her bir sodyum iyonu altı klorür iyonu ile her bir klorür iyonu da altı sodyum iyonu ile çevrilmiştir. Kristal içerisinde iyonların bu şekilde düzenlenmesiyle benzer yüklü iyonların birbirlerini itmeleri, zıt yüklü iyonların birbirlerini çekmeleri tarafından bastırıldığı için net çekim kristalibir arada tutar.
Kovalent bağ
[değiştir | kaynağı değiştir]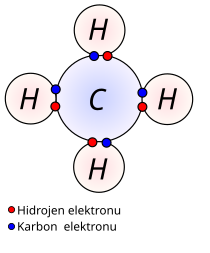
Elektronları bağlamak için girilen rekabet, iyonik bağda olduğu kadar kararlı değilse, atomların dış elektronları paylaşılır ve bir ortaklaşma bağı ya da kovalent bağ oluşur.
Ametal atomları etkileştiği zaman kovalent bağlarda bir arada tutulan moleküller oluşur. Bu atomlar elektron çekimi bakımından birbirlerine benzediklerinden, kovalent bağların oluşması sırasında herhangi bir elektron aktarımı olmaz. Bunun yerine elektronlar ortaklaşa kullanılırlar. Kovalent bir bağ genellikle iki atom tarafından parçalanmış ters spinli bir elektron çifti içerir. Kovalent bağlar yapısına göre ikiye ayrılır:
Apolar kovalent bağlar: Aynı cins iki ametal atomunun birleşmesiyle oluşur. Apolar kovalent bağa en iyi örneklerden biri, iki oksijen atomunun elektronlarını ortaklaşa kullanarak oluşturdukları bağdır. Bu bağda ortaklaşa kullanılan elektronlar eşit paylaşıldığından dolayı molekülün pozitif veya negatif kutbu yoktur.
Polar kovalent bağlar: İki farklı cins atomun bir araya gelmesiyle oluşur. Bu bağlarda ametallerden biri ortaklaşa kullanıldığından dolayı molekülün bir ucu pozitif (+), diğer ucu negatif (-) yüklenir. Suyu oluşturan hidrojen ve oksijen moleküllerinin son orbitallerindeki elektronların ortak kullanılmasıyla polar kovalent bağ oluşur.
Örnek olarak, iki hidrojen atomundan oluşan bir bağ düşünülebilir. Her bir hidrojen atomu 1s orbitalinde atom çekirdeği etrafında simetrik bir dağılım gösteren tek bir elektrona sahiptir. İki hidrojen atomu bir kovalent bağ oluşturduğu zaman atomik orbitaller öyle bir şekilde üst üste binerler, böylece çekirdekler arasındaki bölgede elektron bulutları birbirlerini destekleyip bu bölgedeki elektronun bulunma olasılığını arttırırlar. Pauli dışlama ilkesine göre bağı oluşturan iki elektron mutlaka ters spinli olmalıdır. Bir kovalent bağın kuvveti, pozitif yüklü çekirdek ile bağa ilişkin negatif elektron bulutu arasındaki çekimden gelir.
Metalik bağlar
[değiştir | kaynağı değiştir]Metallerin iyonlaşma enerjileri ile elektro-negatiflikleri oldukça düşüktür. Bunun sonucu olarak metal atomlarının en dış elektronları nispeten gevşek tutulur. Metalik bir kristalde, en dış elektronları çıkarılmış atomlardan ibaret olan pozitif iyonlar kristal örgüde ilgili yerlerde bulunur ve en dış elektronların örgünün her tarafında serbestçe hareket etmesiyle de kristaldeki atomlar bir arada tutulur. Diğer bir deyişle örgü içerisinde dağılan ve kristalin bütününe ait olan elektron bulutu ile pozitif iyonlar arasındaki elektrostatik çekim metalik bağı oluşturmaktadır.
Bant kuramı
[değiştir | kaynağı değiştir]Bant kuramı metalik bağlanma şeklini, tüm kristalin her tarafını kapsayan moleküler orbitaller cinsinden açıklayan kuram.
Metalik katıların çoğu hareketlidir. Bunun sonucu olan artı iyonlar, genişlemiş bir üç boyutlu diziliş içinde yer alırlar; ama elektronlar yöresizleşir. Bu maddelerin yüksek ısı, iletkenliği, dayanıklılık, yüksek kaynama noktası, yüksek yoğunluk, renk ve elektrik iletkenliği gibi özelliklerinin birçoğu, hareketli elektronlardan kaynaklanır. Yalnızca birkaç iyon yığışması şeması uygulanabilir ve X ışını çözümlemesi, metal iyonlarının genişlemiş örgülü yapı içinde kazandığı bağ uzunlukları ve geometrik şekiller konusunda ayrıntılı bilgi sağlar. Basit küp biçimi şekiller, ortada başka bir iyonun bulunduğu küp biçimi şekiller ve altıgen yığışma, en sık rastlanan şekillerdir. Metal alaşımları, erimiş haldeki metallerin karıştırıldıktan sonra dikkatlice soğutulmasıyla elde edilir. Bu yolla oluşan gereçlerin özellikleri bileşenlerinin özelliklerinden genellikle çok farklıdır.
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b "Kimyasal Bağlar" (PDF). İTÜ. 13 Nisan 2014 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 6 Ağustos 2011.
- ^ Levine, Daniel S.; Head-Gordon, Martin (29 Eylül 2020). "Clarifying the quantum mechanical origin of the covalent chemical bond". Nature Communications. 11 (1). Springer Science and Business Media LLC. s. 4893. doi:10.1038/s41467-020-18670-8. ISSN 2041-1723. PMC 7524788 $2. PMID 32994392.
- ^
“ Insert the text of the quote here, without quotation marks. „ - ^ Hund, F. (1928). "Zur Deutung der Molekelspektren. IV". Zeitschrift für Physik (Almanca). 51 (11–12). ss. 759-795. doi:10.1007/BF01400239. ISSN 1434-6001.
- ^ Frenking, Gernot; Krapp, Andreas (15 Ocak 2007). "Unicorns in the world of chemical bonding models". Journal of Computational Chemistry (İngilizce). 28 (1). ss. 15-24. doi:10.1002/jcc.20543. PMID 17109434. 8 Nisan 2023 tarihinde kaynağından arşivlendi.
- ^ Jensen, Frank (1999). Introduction to Computational Chemistry. John Wiley and Sons. ISBN 978-0-471-98425-2.
- ^ Pauling, Linus (1960). "The Concept of Resonance". The Nature of the Chemical Bond – An Introduction to Modern Structural Chemistry (3cü bas.). Cornell University Press. ss. 10-13. ISBN 978-0801403330.
- ^
“ Insert the text of the quote here, without quotation marks. „

